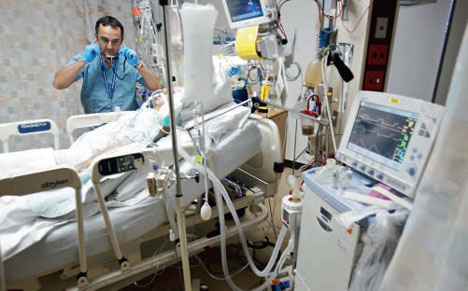
集中治療室(ICU)
intensive care unit

ICU patients often require mechanical ventilation if they have lost the ability to breathe normally.
☆ 集中治療室(ICU)は、集中治療室、集中治療室(ITU)、重症治療室(CCU)とも呼ばれ、集中治療医療を提供する病院や医療施設の特別な部門であ る。 集中治療室は、重症または生命を脅かすような病気やけがをした患者を対象としており、正常な身体機能を確保するために、生命維持装置や薬物による絶え間な いケアと厳重な監視が必要とされる。ICUには、重症患者のケアを専門とする高度な訓練を受けた医師、看護師、呼吸療法士が配置されている。ICUはま た、一般病棟とは異なり、患者に対するスタッフの割合が高く、他では通常利用できない高度な医療資源や医療機器を利用できる。ICUで治療される一般的な 疾患には、急性呼吸窮迫症候群、敗血症性ショック、その他の生命を脅かす疾患がある。 患者は、急速に悪化した場合は救急部や病棟から直接紹介されることもあるし、手術が侵襲的で合併症のリスクが高い場合は手術直後に紹介されることもある [1]。
| An intensive care
unit (ICU), also known as an intensive therapy unit or intensive
treatment unit (ITU) or critical care unit (CCU), is a special
department of a hospital or health care facility that provides
intensive care medicine. Intensive care units cater to patients with severe or life-threatening illnesses and injuries, which require constant care and close supervision from life-support equipment and medication in order to ensure normal bodily functions. They are staffed by highly trained physicians, nurses and respiratory therapists who specialize in caring for critically ill patients. ICUs are also distinguished from general hospital wards by a higher staff-to-patient ratio and access to advanced medical resources and equipment that is not routinely available elsewhere. Common conditions that are treated within ICUs include acute respiratory distress syndrome, septic shock, and other life-threatening conditions. Patients may be referred directly from an emergency department or from a ward if they rapidly deteriorate, or immediately after surgery if the surgery is very invasive and the patient is at high risk of complications.[1] |
集中治療室(ICU)は、集中治療室、集中治療室(ITU)、重症治療
室(CCU)とも呼ばれ、集中治療医療を提供する病院や医療施設の特別な部門である。 集中治療室は、重症または生命を脅かすような病気やけがをした患者を対象としており、正常な身体機能を確保するために、生命維持装置や薬物による絶え間な いケアと厳重な監視が必要とされる。ICUには、重症患者のケアを専門とする高度な訓練を受けた医師、看護師、呼吸療法士が配置されている。ICUはま た、一般病棟とは異なり、患者に対するスタッフの割合が高く、他では通常利用できない高度な医療資源や医療機器を利用できる。ICUで治療される一般的な 疾患には、急性呼吸窮迫症候群、敗血症性ショック、その他の生命を脅かす疾患がある。 患者は、急速に悪化した場合は救急部や病棟から直接紹介されることもあるし、手術が侵襲的で合併症のリスクが高い場合は手術直後に紹介されることもある [1]。 |
| History See also: Intensive care medicine In 1854, Florence Nightingale left for the Crimean War, where triage was used to separate seriously wounded soldiers from those with non-life-threatening conditions. Until recently,[when?] it was reported that Nightingale's method reduced mortality from 40% to 2% on the battlefield. Although this was not the case, her experiences during the war formed the foundation for her later discovery of the importance of sanitary conditions in hospitals, a critical component of intensive care. In response to a polio epidemic (where many patients required constant ventilation and surveillance), Bjørn Aage Ibsen established the first intensive care unit globally in Copenhagen in 1953.[2][3] The first application of this idea in the United States was in 1951 by Dwight Harken. Harken's concept of intensive care has been adopted worldwide and has improved the chance of survival for patients. He opened the first intensive care unit in 1951. In the 1960s, he developed the first device to help the heart pump. He also implanted artificial aortic and mitral valves. He continued to pioneer in surgical procedures for operating on the heart. He established and worked in several organizations related to the heart. In 1955, William Mosenthal, a surgeon at the Dartmouth-Hitchcock Medical Center also opened an early intensive care unit.[4] In the 1960s, the importance of cardiac arrhythmias as a source of morbidity and mortality in myocardial infarctions (heart attacks) was recognized. This led to the routine use of cardiac monitoring in ICUs, especially after heart attacks.[5] https://en.wikipedia.org/wiki/Intensive_care_unit ++++++++++++++++++++++++++ Dwight Emary Harken (1910–1993) was an American surgeon. He was an innovator in heart surgery and introduced the concept of the intensive care unit. Life Dwight Harken was born in Osceola, Iowa. He received his Bachelor's and Medical degrees from Harvard. While working at the Bellevue hospital in New York, he was awarded a fellowship to London to continue his studies in medicine. During the Second World War, Harken served in the U.S. Army Medical Corps in London as a surgeon and had previously operated alongside Tudor Edwards.[1] To treat his patients, he found a way to take out shrapnel safely from the heart by cutting into the wall of a beating heart, then inserting a finger to locate and remove the shrapnel. With this method, he became the first person to have repeated success in heart operation after removing shrapnel from the hearts of 134 soldiers during World War II without a single fatality.[2] In 1948, Harken discovered a way similar to how he operated on soldiers to correct mitral stenosis. A small hole would be cut in the heart and a finger would be used to widen the valve. This technique became known as blind surgery or closed heart surgery. At first, the majority of patients died, however as the method was refined, the fatality rate dropped and became safe. Harken's concept of intensive care has been adopted worldwide and has improved the chance of survival for patients. He opened the first intensive care unit in 1951. In the 1960s, he developed the first device to help the heart pump. He also implanted artificial aortic and mitral valves. He continued to pioneer in surgical procedures for operating on the heart. He established and worked in several organizations related to the heart. After the war, Harken taught for two years at Tufts University before returning to Harvard, where he would teach and serve as chief of thoracic surgery for the next 22 years. He died in 1993 in Cambridge, Massachusetts. References Fong, Kevin (2013-03-14). Extremes: Life, Death and the Limits of the Human Body. Hodder & Stoughton. ISBN 9781444737769. McRae, D. (2007-08-07). Every Second Counts: The Race to Transplant the First Human Heart (p. 78). Penguin Group. Kindle Edition. https://en.wikipedia.org/wiki/Dwight_Harken |
沿革 こちらも参照のこと: 集中治療医学 1854年、フローレンス・ナイチンゲールはクリミア戦争に出征し、重傷兵と命に別状がない兵とを分けるためにトリアージが行われた。 最近まで[いつ?]、ナイチンゲールの方法によって戦場での死亡率が40%から2%に減少したと報告されていた。これは事実ではなかったが、戦時中の彼女の経験は、後に集中治療の重要な要素である病院内の衛生状態の重要性を発見する礎となった。 ポリオの流行(多くの患者が常時換気と監視を必要とした)に対応して、ビョルン・アーゲ・イプセンは1953年にコペンハーゲンに世界初の集中治療室を設立した[2][3]。 米国でこの考えが最初に適用されたのは、1951年にドワイト・ハーケンによってであった。ハーケンの集中治療の概念は世界中で採用され、患者の生存率を 向上させた。彼は1951年に最初の集中治療室を開設した。1960年代には、心臓のポンプ機能を助ける最初の装置を開発した。また、人工大動脈弁と人工 僧帽弁を移植した。心臓の外科手術のパイオニアであり続けた。心臓に関連するいくつかの組織を設立し、活動した。 1955年には、ダートマス-ヒッチコック医療センターの外科医であったウィリアム・モーゼンタールも初期の集中治療室を開設した[4]。 1960年代には、心筋梗塞(心臓発作)における罹患率や死亡率の原因としての心臓不整脈の重要性が認識された。このため、ICUでは、特に心臓発作後に 心臓モニタリングが日常的に行われるようになった[5]。 ++++++++++++++++++++++++++ ドワイト・エマリー・ハーケン(1910-1993)はアメリカの外科医である。心臓手術の革新者であり、集中治療室の概念を導入した。 生涯 ドワイト・ハーケンはアイオワ州オシオラに生まれた。ハーバード大学で学士号と医学士号を取得した。ニューヨークのベルビュー病院で働きながら、医学の勉強を続けるためにロンドンへのフェローシップを授与された。 第二次世界大戦中、ハーケンはロンドンのアメリカ陸軍医療部隊に外科医として従軍し、以前はチューダー・エドワーズとともに手術を行っていた[1]。患者 を治療するため、彼は拍動している心臓の壁に切り込みを入れ、次に指を挿入して破片を見つけ、取り除くことによって、心臓から破片を安全に取り出す方法を 発見した。この方法で彼は、第二次世界大戦中に134人の兵士の心臓から破片を一人の死者も出さずに取り除き、心臓手術で繰り返し成功を収めた最初の人物 となった[2]。 1948年、ハーケンは、僧帽弁狭窄症を改善するために兵士を手術した方法と同様の方法を発見した。心臓に小さな穴を開け、指で弁を広げるのである。この 手技は、ブラインド手術あるいは閉鎖式心臓手術として知られるようになった。当初は患者の大半が死亡したが、方法が改良されるにつれて致死率は下がり、安 全な手術となった。 ハーケンの集中治療の概念は世界中で採用され、患者の生存率を向上させた。彼は1951年に最初の集中治療室を開設した。1960年代には、心臓のポンプ 機能を助ける最初の装置を開発した。また、人工大動脈弁と人工僧帽弁を移植した。心臓の外科手術のパイオニアであり続けた。心臓に関連するいくつかの団体 を設立し、活動した。 戦後、ハーケンはタフツ大学で2年間教鞭をとった後、ハーバード大学に戻り、以後22年間教鞭をとり、胸部外科のチーフを務めた。1993年、マサチューセッツ州ケンブリッジで死去した。 参考文献 Fong, Kevin (2013-03-14). Extremes: 生、死、そして人体の限界。Hodder & Stoughton. ISBN 978414737769. McRae, D. (2007-08-07). Every Seconds Counts: The Race to Transplant the First Human Heart (p. 78). ペンギン・グループ。Kindle版。 |
| Types Hospitals may have various specialized ICUs that cater to a specific medical requirement or patient: 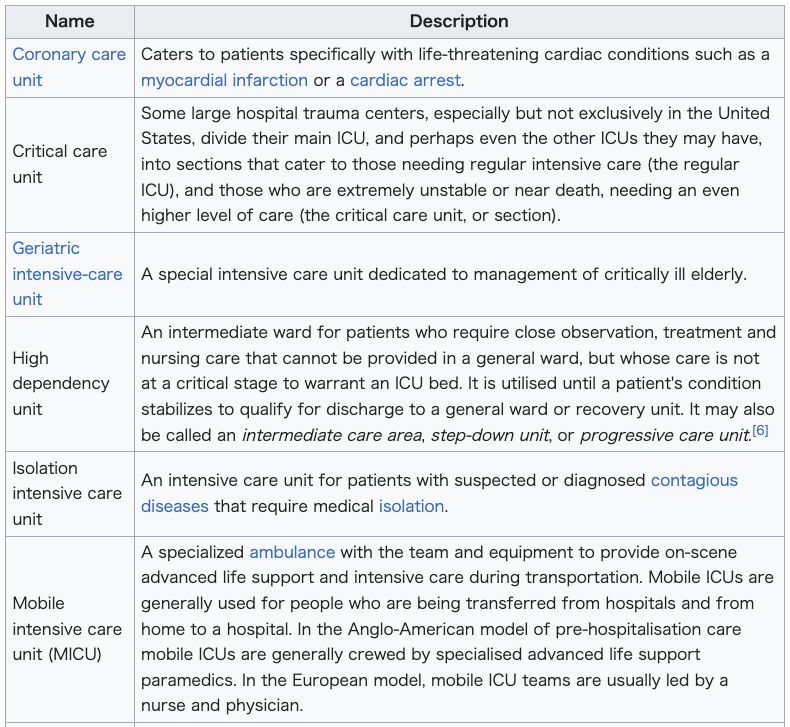 |
種類 病院には、特定の医療要件や患者に対応する様々な専門ICUがある: 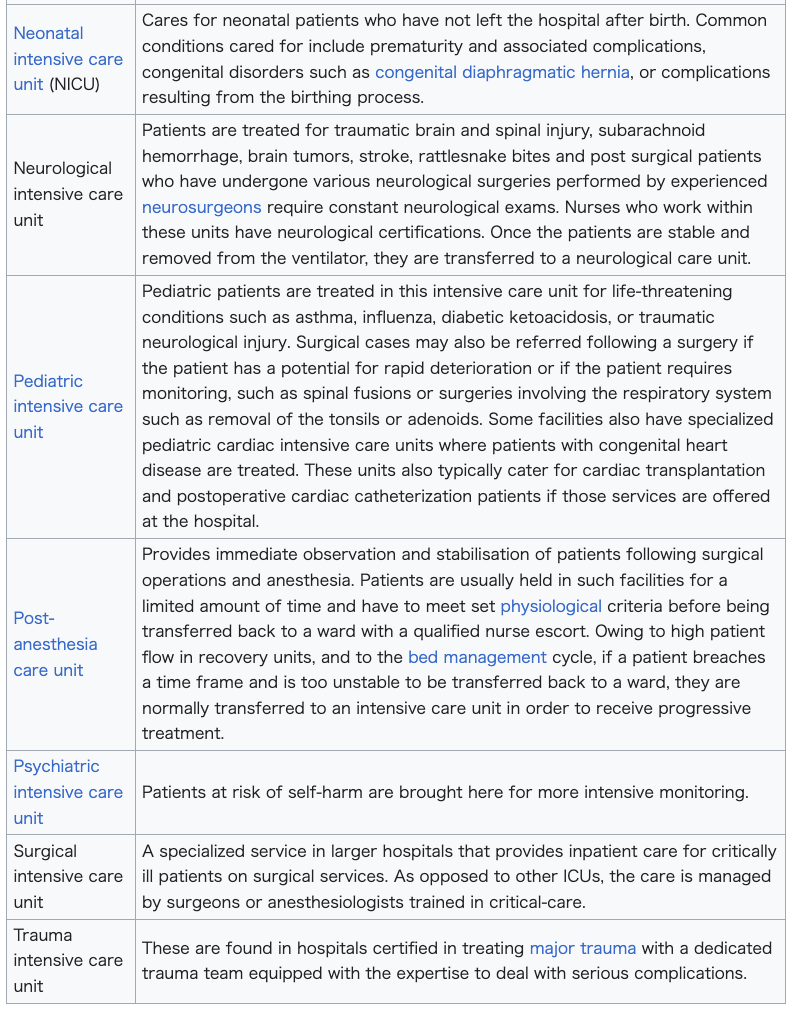 |
| Equipment and systems Common equipment in an ICU includes mechanical ventilators to assist breathing through an endotracheal tube or a tracheostomy tube; cardiac monitors for monitoring Cardiac condition; equipment for the constant monitoring of bodily functions; a web of intravenous lines, feeding tubes, nasogastric tubes, suction pumps, drains, and catheters, syringe pumps; and a wide array of drugs to treat the primary condition(s) of hospitalization. Medically induced comas, analgesics, and induced sedation are common ICU tools needed and used to reduce pain and prevent secondary infections. Further information: Burn recovery bed Quality of care The available data suggests a relation between ICU volume and quality of care for mechanically ventilated patients.[7] After adjustment for severity of illnesses, demographic variables, and characteristics of different ICUs (including staffing by intensivists), higher ICU staffing was significantly associated with lower ICU and hospital mortality rates. A ratio of 2 patients to 1 nurse is recommended for a medical ICU, which contrasts to the ratio of 4:1 or 5:1 typically seen on medical floors. This varies from country to country, though; e.g., in Australia and the United Kingdom, most ICUs are staffed on a 2:1 basis (for high-dependency patients who require closer monitoring or more intensive treatment than a hospital ward can offer) or on a 1:1 basis for patients requiring extreme intensive support and monitoring; for example, a patient on multiple vasoactive medications to keep their blood pressure high enough to perfuse tissue. The patient may require multiple machines; Examples: continuous dialysis CRRT, a intra-aortic balloon pump, ECMO. International guidelines recommend that every patient gets checked for delirium every day (usually twice or as much required) using a validated clinical tool. The two most widely used are the Confusion Assessment Method for the ICU (CAM-ICU) and the Intensive Care Delirium Screening Checklist (ICDSC). There are translations of these tools in over 20 languages and they are used globally in many ICU's.[8] Nurses are the largest group of healthcare professionals working in ICUs. There are findings which have demonstrated that nursing leadership styles have impact on ICU quality measures [9] particularly structural and outcomes measures. Operational logistics In the United States, up to 20% of hospital beds can be labelled as intensive-care beds; in the United Kingdom, intensive care usually will comprise only up to 2% of total beds. This high disparity is attributed to admission of patients in the UK only when considered the most severely ill.[10] Intensive care is an expensive healthcare service. A recent study conducted in the United States found that hospital stays involving ICU services were 2.5 times more costly than other hospital stays.[11] In the United Kingdom in 2003–04, the average cost of funding an intensive care unit was:[12] £838 per bed per day for a neonatal intensive care unit £1,702 per bed per day for a pediatric intensive care unit £1,328 per bed per day for an adult intensive care unit Remote collaboration systems Some hospitals have installed teleconferencing systems that allow doctors and nurses at a central facility (either in the same building, at a central location serving several local hospitals, or in rural locations another more urban facility) to collaborate with on-site staff and speak with patients (a form of [telemedicine]). This is variously called an eICU, virtual ICU, or tele-ICU. Remote staff typically have access to vital signs from live monitoring systems, and telectronic health records so they may have access to a broader view of a patient's medical history. Often bedside and remote staff have met in person and may rotate responsibilities. Such systems are beneficial to intensive care units in order to ensure correct procedures are being followed for patients vulnerable to deterioration, to access vital signs remotely in order to keep patients that would have to be transferred to a larger facility if need be he/she may have demonstrated a significant decrease in stability.[13][14][15][16] |
設備とシステム 気管内チューブや気管切開チューブを通して呼吸を補助する機械式人工呼吸器、心臓の状態をモニターする心臓モニター、身体機能を常時モニターする機器、静 脈ライン、栄養チューブ、経鼻胃管、吸引ポンプ、ドレーン、カテーテル、シリンジポンプ、入院中の主な病態を治療するための多種多様な薬剤などである。医 療的昏睡、鎮痛剤、鎮静剤は、痛みを軽減し、二次感染を予防するために必要とされ、使用されるICUの一般的な手段である。 さらに詳しい情報 熱傷回復ベッド ケアの質 入手可能なデータから、機械的人工呼吸患者のICU収容量とケアの質との関係が示唆されている [7] 。重症度、人口統計学的変数、およびさまざまなICUの特徴(集中治療専門医による人員配置を含む)を調整した結果、ICUの人員配置が多いほどICUお よび病院での死亡率が低いことと有意に関連していた。医療ICUでは患者2対看護師1の割合が推奨されており、一般的に医療フロアでみられる4対1または 5対1とは対照的である。しかし、これは国によって異なる。例えば、オーストラリアやイギリスでは、ほとんどのICUは2:1(病棟が提供できるよりも緊 密な監視や集中的な治療を必要とする高依存度の患者)、または極度に集中的なサポートや監視を必要とする患者(例えば、組織灌流に十分な高血圧を維持する ために複数の血管作動薬を服用している患者)に対しては1:1でスタッフが配置されている。例えば、持続透析CRRT、大動脈内バルーンポンプ、ECMO などである。 国際的なガイドラインでは、検証された臨床ツールを用いて、すべての患者に毎日(通常2回または必要なだけ)せん妄のチェックを行うことを推奨している。 最も広く使用されているのは、ICUにおける錯乱評価法(CAM-ICU)と集中治療せん妄スクリーニングチェックリスト(ICDSC)である。これらの ツールは20以上の言語に翻訳されており、多くのICUで世界的に使用されている[8]。看護師のリーダーシップスタイルがICUの質指標 [9] 、特に構造的指標とアウトカム指標に影響を与えるという知見がある。 運営上のロジスティクス 米国では病院病床の最大20%が集中治療病床とされるが、英国では集中治療病床は通常全病床の2%にすぎない。この大きな格差は、英国では患者が最も重篤と考えられる場合にのみ入院することに起因している [10] 。 集中治療は高額な医療サービスである。米国で実施された最近の研究によると、ICUサービスを伴う入院は、他の入院に比べ2.5倍の費用がかかることがわかった[11]。 2003-04年のイギリスでは、集中治療室の資金調達にかかる平均費用は以下の通りであった[12]。 新生児集中治療室では、1日1ベッドあたり838ポンドであった。 小児集中治療室は1日1床あたり1,702ポンドである。 成人集中治療室:1ベッド1日あたり1,328ポンド 遠隔連携システム 一部の病院では、遠隔会議システムを導入し、中央施設(同じ建物内、複数の地方病院を管轄する中央施設、または地方にある別の都市施設)の医師や看護師 が、現場のスタッフと協力したり、患者と話したりできるようにしている([遠隔医療]の一形態)。これはeICU、バーチャルICU、遠隔ICUなどと呼 ばれる。遠隔スタッフは通常、ライブモニタリングシステムからのバイタルサインや電子カルテにアクセスできるため、患者の病歴をより広く知ることができ る。多くの場合、ベッドサイドスタッフと遠隔スタッフは直接顔を合わせ、担当を交代することもある。このようなシステムは集中治療室にとって有益であり、 悪化しやすい患者に対して正しい手順が踏まれていることを確認し、バイタルサインに遠隔からアクセスすることで、必要であればより大きな施設に移送しなけ ればならない患者を維持し、彼/彼女は安定性が著しく低下していることを示すことができる[13][14][15][16]。 |
| ICU quality and management tools Intensive Care Foundation, a charity in Australia and New Zealand Intensive Care Medicine (journal) Neonatal intensive care unit Open-source ventilator Pediatric intensive care unit |
ICUの質と管理ツール 集中治療財団(オーストラリアとニュージーランドの慈善団体 集中治療医学(雑誌) 新生児集中治療室 オープンソースの人工呼吸器 小児集中治療室 |
| https://en.wikipedia.org/wiki/Intensive_care_unit |
|
リ ンク
文 献
そ の他の情報
Copyleft, CC, Mitzub'ixi Quq Chi'j, 1996-2099
☆
 ☆
☆