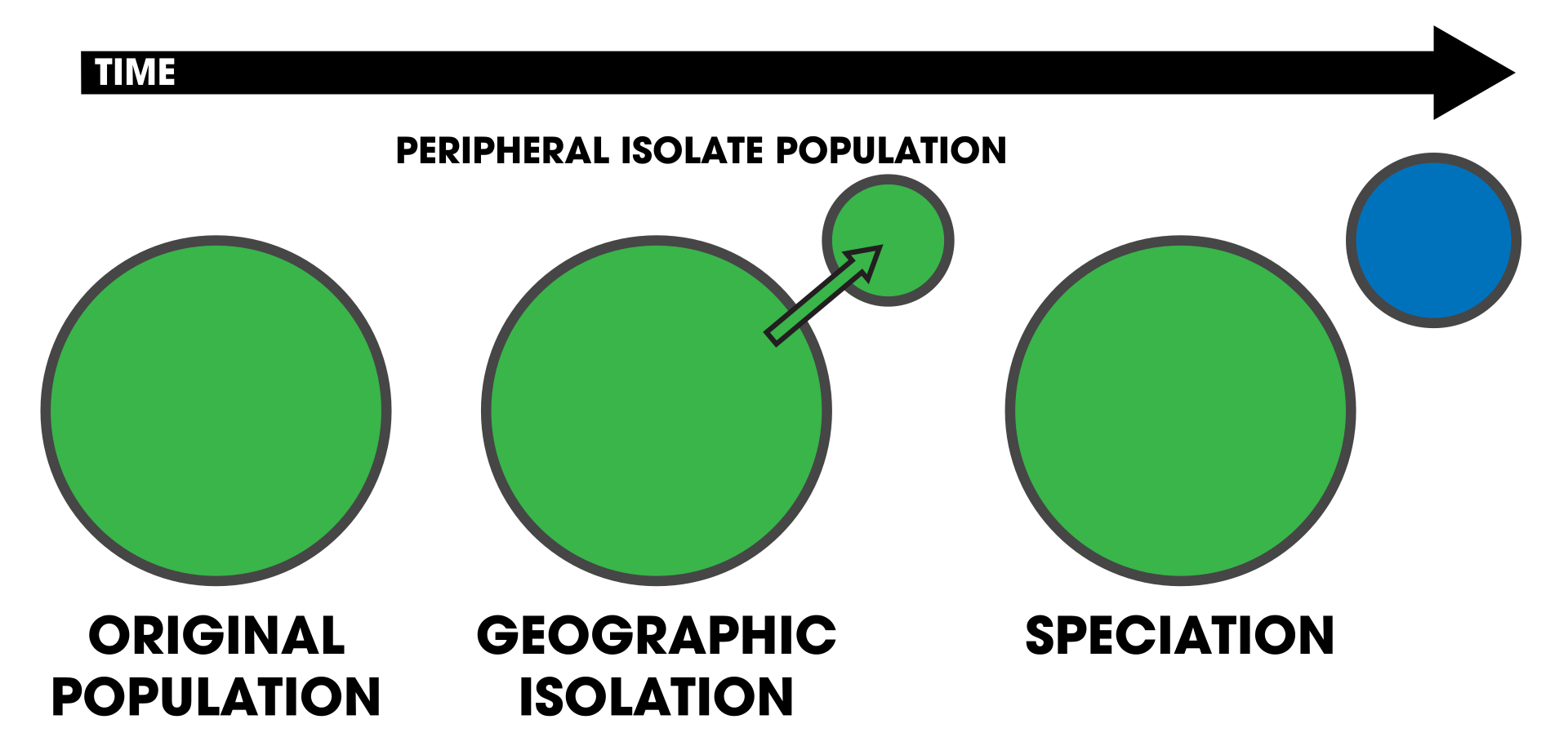
周辺域における種形成
Peripatric speciation

☆ 周辺個体群分化(Peripatric speciation) は、孤立した周辺個体群から新種が形成される種の進化の様式である。[1]: 105 周辺個体群分化は、個体群が孤立し、遺伝子の交換が妨げられるという点で、異所的種分化に類似しているため、両者を区別することはしばしば困難である。 [2] また、 隔離個体群による種分化は、隔離個体群による種分化の一種またはモデルであると考えられる場合もある。[3] 隔離個体群による種分化の主な特徴は、一方の個体群が他方よりもはるかに小さいことである。これは、(他のタイプの)隔離個体群による種分化とは対照的で あり、同程度の規模の個体群が分離する。ペリパトリックおよびペリパトリという用語は生物地理学で頻繁に使用され、生息域が近接しているが重複しておら ず、これらの生物が生息していない場所で隔てられている生物を指す。例えば、大陸と海洋島などである。このような生物は通常、近縁(例えば姉妹種)であ り、その分布はペリパトリック種分化の結果である。 周辺種分化の概念は、進化生物学者エルンスト・マイヤーによって1954年に初めて概説された。[4] それ以来、他の代替モデルも開発されている。例えば、種の個体群が地理的範囲の拡大期を経て縮小期に入り、主要個体群の周辺に孤立した小規模な個体群を残 すとする遠心種分化などである。他のモデルでは、限られた個体数に対する性淘汰の影響が取り入れられている。また、周辺的に孤立した個体群に関する関連モ デルとして、染色体再編成に基づく新種形成や量子種形成などのモデルも開発されている。 周辺種分化の存在は、観察結果や実験室での実験によって裏付けられている。[1]:106 ある種の生物地理学的分布のパターンや系統発生上の関係を観察する科学者は、それらが分岐した歴史的プロセスを再構築することができる。さらに、海洋島は 孤立した生息地であるため、周辺種分化の研究対象となることが多い。ハワイ諸島は、科学文献の多くで広く取り上げられている。


図1.
周辺域における種分化;図2.遠心分離による種分化;
周辺種分化と遠心分離による種分化のプロセスを表す遠心分離による種分化図。周辺種分化では、小集団が中心集団の周辺で孤立し、遺伝子流動の減少により生
殖的隔離が進化する(青)。遠心分離による種分化では、元の集団(緑)の範囲が拡大と縮小を繰り返し、孤立した断片集団が残される。中心集団(青に変更)
は、周辺種分化とは対照的に、生殖的隔離が進化する。
| Peripatric
speciation is a mode of speciation in which a new species is formed
from an isolated peripheral population.[1]: 105 Since peripatric
speciation resembles allopatric speciation, in that populations are
isolated and prevented from exchanging genes, it can often be difficult
to distinguish between them.[2], and peripatric speciation may be
considered one type or model of allopatric speciation.[3] The primary
distinguishing characteristic of peripatric speciation is that one of
the populations is much smaller than the other, as opposed to (other
types of) allopatric speciation, in which similarly-sized populations
become separated. The terms peripatric and peripatry are often used in
biogeography, referring to organisms whose ranges are closely adjacent
but do not overlap, being separated where these organisms do not
occur—for example on an oceanic island compared to the mainland. Such
organisms are usually closely related (e.g. sister species); their
distribution being the result of peripatric speciation. The concept of peripatric speciation was first outlined by the evolutionary biologist Ernst Mayr in 1954.[4] Since then, other alternative models have been developed such as centrifugal speciation, that posits that a species' population experiences periods of geographic range expansion followed by shrinking periods, leaving behind small isolated populations on the periphery of the main population. Other models have involved the effects of sexual selection on limited population sizes. Other related models of peripherally isolated populations based on chromosomal rearrangements have been developed such as budding speciation and quantum speciation. The existence of peripatric speciation is supported by observational evidence and laboratory experiments.[1]: 106 Scientists observing the patterns of a species biogeographic distribution and its phylogenetic relationships are able to reconstruct the historical process by which they diverged. Further, oceanic islands are often the subject of peripatric speciation research due to their isolated habitats—with the Hawaiian Islands widely represented in much of the scientific literature. |
周辺個体群分化は、孤立した周辺個体群から新種が形成される種の進化の
様式である。[1]: 105
周辺個体群分化は、個体群が孤立し、遺伝子の交換が妨げられるという点で、異所的種分化に類似しているため、両者を区別することはしばしば困難である。
[2] また、 隔離個体群による種分化は、隔離個体群による種分化の一種またはモデルであると考えられる場合もある。[3]
隔離個体群による種分化の主な特徴は、一方の個体群が他方よりもはるかに小さいことである。これは、(他のタイプの)隔離個体群による種分化とは対照的で
あり、同程度の規模の個体群が分離する。ペリパトリックおよびペリパトリという用語は生物地理学で頻繁に使用され、生息域が近接しているが重複しておら
ず、これらの生物が生息していない場所で隔てられている生物を指す。例えば、大陸と海洋島などである。このような生物は通常、近縁(例えば姉妹種)であ
り、その分布はペリパトリック種分化の結果である。 周辺種分化の概念は、進化生物学者エルンスト・マイヤーによって1954年に初めて概説された。[4] それ以来、他の代替モデルも開発されている。例えば、種の個体群が地理的範囲の拡大期を経て縮小期に入り、主要個体群の周辺に孤立した小規模な個体群を残 すとする遠心種分化などである。他のモデルでは、限られた個体数に対する性淘汰の影響が取り入れられている。また、周辺的に孤立した個体群に関する関連モ デルとして、染色体再編成に基づく新種形成や量子種形成などのモデルも開発されている。 周辺種分化の存在は、観察結果や実験室での実験によって裏付けられている。[1]:106 ある種の生物地理学的分布のパターンや系統発生上の関係を観察する科学者は、それらが分岐した歴史的プロセスを再構築することができる。さらに、海洋島は 孤立した生息地であるため、周辺種分化の研究対象となることが多い。ハワイ諸島は、科学文献の多くで広く取り上げられている。 |
History Main article: History of speciation Peripatric speciation was originally proposed by Ernst Mayr in 1954,[4] and fully theoretically modeled in 1982.[5] It is related to the founder effect, where small living populations may undergo selection bottlenecks.[6] The founder effect is based on models that suggest peripatric speciation can occur by the interaction of selection and genetic drift,[1]: 106 which may play a significant role.[7] Mayr first conceived of the idea by his observations of kingfisher populations in New Guinea and its surrounding islands.[1]: 389 Tanysiptera galatea was largely uniform in morphology on the mainland, but the populations on the surrounding islands differed significantly—referring to this pattern as "peripatric".[1]: 389 This same pattern was observed by many of Mayr's contemporaries at the time such as by E. B. Ford's studies of Maniola jurtina.[8]: 522 Around the same time, the botanist Verne Grant developed a model of quantum speciation very similar to Mayr's model in the context of plants.[9]  In what has been called Mayr's genetic revolutions, he postulated that genetic drift played the primary role that resulted in this pattern.[1]: 389 Seeing that a species cohesion is maintained by conservative forces such as epistasis and the slow pace of the spread of favorable alleles in a large population (based heavily on J. B. S. Haldane's calculations), he reasoned that speciation could only take place in which a population bottleneck occurred.[1]: 389 A small, isolated, founder population could be established on an island for example. Containing less genetic variation from the main population, shifts in allele frequencies may occur from different selection pressures.[1]: 390 This to further changes in the network of linked loci, driving a cascade of genetic change, or a "genetic revolution"—a large-scale reorganization of the entire genome of the peripheral population.[1]: 391 Mayr did recognize that the chances of success were incredibly low and that extinction was likely; though noting that some examples of successful founder populations existed at the time.[8]: 522 Shortly after Mayr, William Louis Brown, Jr. proposed an alternative model of peripatric speciation in 1957 called centrifugal speciation. In 1976 and 1980, the Kaneshiro model of peripatric speciation was developed by Kenneth Y. Kaneshiro which focused on sexual selection as a driver for speciation during population bottlenecks.[10][11][12] |
歴史 詳細は「種の分化の歴史」を参照 辺境種分化説は、もともと1954年にエルンスト・マイヤーによって提唱され[4]、1982年に完全に理論的にモデル化された[5]。これは、小さな生 息個体群が選択のボトルネックを受ける可能性があるという創始者効果に関連している[6]。創始者効果は、選択と遺伝的浮動の相互作用によって辺境種分化 が起こりうることを示唆するモデルに基づいている[1]: 106であり、重要な役割を果たしている可能性がある。[7] マイヤーはニューギニアとその周辺の島々におけるカワセミの個体群の観察から、この考えを最初に着想した。[1]: 389 Tanysiptera galatea は本土では形態がほぼ均一であったが、周辺の島々の個体群は著しく異なっていた。このパターンを「周辺個体群」と呼ぶ。[1 : 389 この同じパターンは、E. B. フォードによるマニオラ・ユルティナの研究など、当時メイアと同時代に活躍した多くの科学者によって観察されていた。[8]: 522 ほぼ同時期に、植物学者のヴァーン・グラントは、植物の文脈においてメイアのモデルと非常に類似した量子種分化モデルを開発した。[9]  マイヤーの遺伝子革命と呼ばれるものの中で、彼は、このパターンを生み出した主な役割は遺伝的浮動であると仮定した。[1]:389 種としてのまとまりは、エピスタシスなどの保守的な力や、 (J. B. S. ハルデーンの計算を大いに参考に)彼は、種分化は個体群のボトルネックが発生した場合にのみ起こりうると論じた。[1]: 389 小さく孤立した創始者集団が、例えば島で形成される可能性がある。母集団からの遺伝的多様性が少ないため、異なる選択圧力から対立遺伝子頻度の変化が起こ る可能性がある。[1]: 390 これがさらに連鎖座位のネットワークの変化につながり、遺伝的変化の連鎖反応、すなわち「遺伝的革命」を引き起こす。周辺集団のゲノム全体の大規模な再編 成である。[1]: 391 メイアは成功の可能性が非常に低いこと、そして絶滅の可能性が高いことを認識していたが、同時に、当時、成功した創始者集団の例もいくつか存在していたこ とを指摘している。[8]: 522 マイヤーのすぐ後、1957年にウィリアム・ルイス・ブラウン・ジュニアが「遠心性種分化」と呼ばれる、マイヤーとは異なる周辺個体群説を提唱した。 1976年と1980年には、ケネス・Y・カネシロが、人口のボトルネック時に種分化の要因となるものとして性的選択に焦点を当てた周辺個体群説のカネシ ロモデルを開発した。[10][11][12] |
| Models Peripatric Peripatric speciation models are identical to models of vicariance (allopatric speciation).[1]: 105 Requiring both geographic separation and time, speciation can result as a predictable byproduct.[13] Peripatry can be distinguished from allopatric speciation by three key features:[1]: 105 The size of the isolated population Strong selection caused by the dispersal and colonization of novel environments, The effects of genetic drift on small populations. The size of a population is important because individuals colonizing a new habitat likely contain only a small sample of the genetic variation of the original population. This promotes divergence due to strong selective pressures, leading to the rapid fixation of an allele within the descendant population. This gives rise to the potential for genetic incompatibilities to evolve. These incompatibilities cause reproductive isolation, giving rise to—sometimes rapid—speciation events.[1]: 105 Furthermore, two important predictions are invoked, namely that geological or climatic changes cause populations to become locally fragmented (or regionally when considering allopatric speciation), and that an isolated population's reproductive traits evolve enough as to prevent interbreeding upon potential secondary contact.[14] The peripatric model results in, what have been called, progenitor-derivative species pairs, whereby the derivative species (the peripherally isolated population)—geographically and genetically isolated from the progenitor species—diverges.[15] A specific phylogenetic signature results from this mode of speciation: the geographically widespread progenitor species becomes paraphyletic (thereby becoming a paraspecies), with respect to the derivative species (the peripheral isolate).[1]: 470 The concept of a paraspecies is therefore a logical consequence of the evolutionary species concept, by which one species gives rise to a daughter species.[16] It is thought that the character traits of the peripherally isolated species become apomorphic, while the central population remains plesiomorphic.[17] Modern cladistic methods have developed definitions that have incidentally removed derivative species by defining clades in a way that assumes that when a speciation event occurs, the original species no longer exists, while two new species arise; this is not the case in peripatric speciation.[9] Mayr warned against this, as it causes a species to lose their classification status.[18] Loren H. Rieseberg and Luc Brouillet recognized the same dilemma in plant classification.[19] Quantum and budding speciation The botanist Verne Grant proposed the term quantum speciation that combined the ideas of J. T. Gulick (his observation of the variation of species in semi-isolation), Sewall Wright (his models of genetic drift), Mayr (both his peripatric and genetic revolution models), and George Gaylord Simpson (his development of the idea of quantum evolution).[20]: 114 Quantum speciation is a rapid process with large genotypic or phenotypic effects, whereby a new, cross-fertilizing plant species buds off from a larger population as a semi-isolated peripheral population.[21][20]: 114 Interbreeding and genetic drift takes place due to the reduced population size, driving changes to the genome that would most likely result in extinction (due to low adaptive value).[20]: 115 In rare instances, chromosomal traits with adaptive value may arise, resulting in the origin of a new, derivative species.[9][22] Evidence for the occurrence of this type of speciation has been found in several plant species pairs: Layia discoidea and L. glandulosa, Clarkia lingulata and C. biloba, and Stephanomeria malheurensis and S. exigua ssp. coronaria.[9] A closely related model of peripatric speciation is called budding speciation—largely applied in the context of plant speciation.[23] The budding process, where a new species originates at the margins of an ancestral range, is thought to be common in plants[23]—especially in progenitor-derivative species pairs.[24] Centrifugal speciation William Louis Brown, Jr. proposed an alternative model of peripatric speciation in 1957 called centrifugal speciation. This model contrasts with peripatric speciation by virtue of the origin of the genetic novelty that leads to reproductive isolation.[25] A population of a species experiences periods of geographic range expansion followed by periods of contraction. During the contraction phase, fragments of the population become isolated as small refugial populations on the periphery of the central population. Because of the large size and potentially greater genetic variation within the central population, mutations arise more readily. These mutations are left in the isolated peripheral populations, promoting reproductive isolation. Consequently, Brown suggested that during another expansion phase, the central population would overwhelm the peripheral populations, hindering speciation. However, if the species finds a specialized ecological niche, the two may coexist.[26][27] The phylogenetic signature of this model is that the central population becomes derived, while the peripheral isolates stay plesiomorphic[17]—the reverse of the general model. In contrast to centrifugal speciation, peripatric speciation has sometimes been referred to as centripetal speciation (see figures 1 and 2 for a contrast).[28] Centrifugal speciation has been largely ignored in the scientific literature, often dominated by the traditional model of peripatric speciation.[29][25][17] Despite this, Brown cited a wealth of evidence to support his model, of which has not yet been refuted.[26] Peromyscus polionotus and P. melanotis (the peripherally isolated species from the central population of P. maniculatus) arose via the centrifugal speciation model.[30] Centrifugal speciation may have taken place in tree kangaroos, South American frogs (Ceratophrys), shrews (Crocidura), and primates (Presbytis melalophos).[29] John C. Briggs associates centrifugal speciation with centers of origin, contending that the centrifugal model is better supported by the data, citing species patterns from the proposed 'center of origin' within the Indo-West Pacific[29] Kaneshiro model 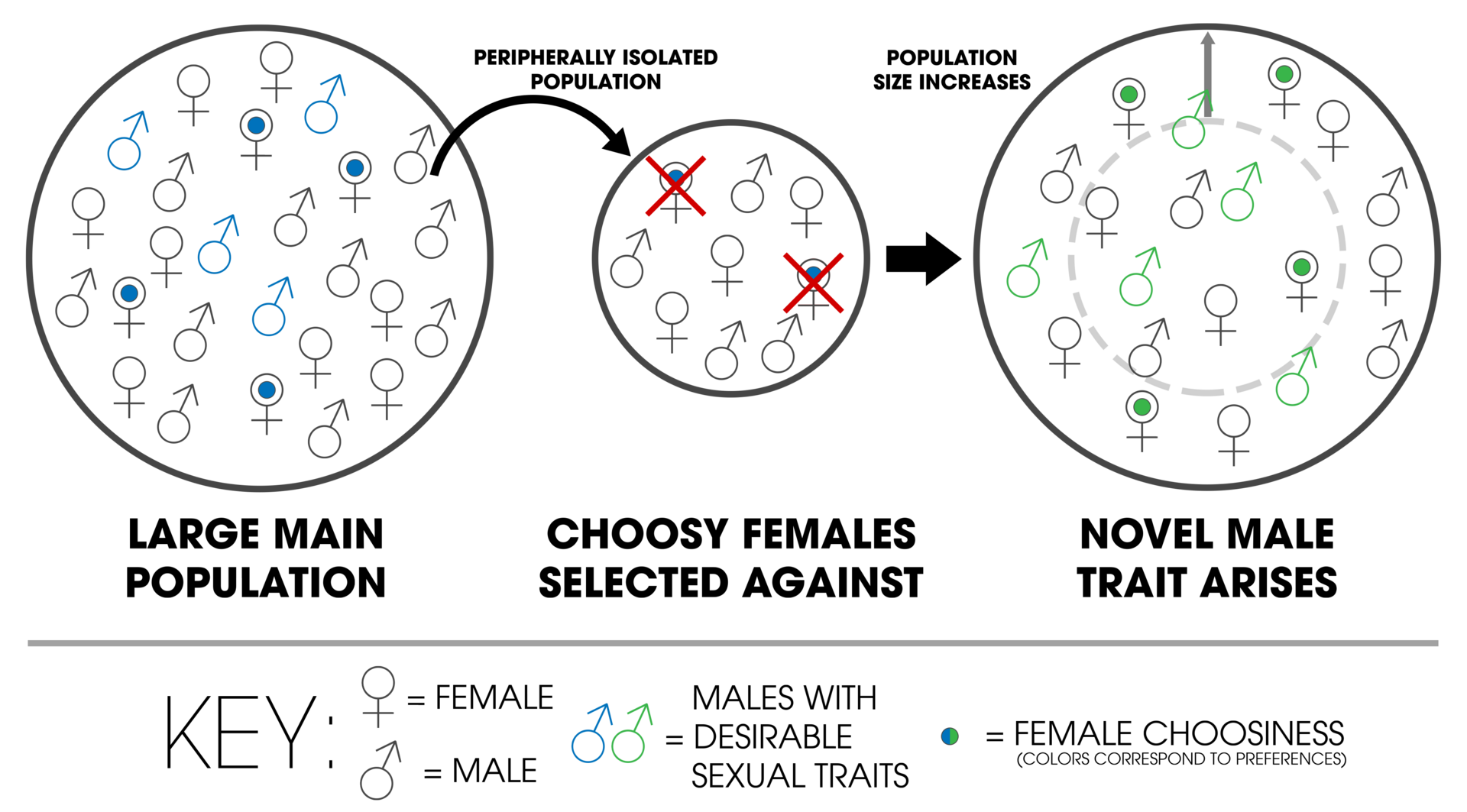 In the Kaneshiro model, a sample of a larger population results in an isolated population with fewer males that are able to lower the threshold of receptivity among females. Over time, choosy females are selected against and there is an increase in frequency of less choosy females resulting in a shift in the gene frequency of the population. Such a condition result in a "destabilized" genetic condition allowing new genetic variants to arise. Novel variants that are better adapted to the new habitat will be selected and over time the genetic makeup of the peripatric population may be different enough to become reproductively isolated from the old one. The Kaneshiro Model also provides an explanation of the mechanism of speciation during founder events as proposed by Ernst Mayr and Hampton Carson. In most cases, founder events result when single fertilized female is accidentally translocated to an entirely different location, e.g., an adjacent island among a chain of islands such as the Hawaiian Archipelago, and produces a few offspring. Such a founder colony is faced with extremely small population size which as described by the Kaneshiro Model, experiences a shift in the mating system towards and increase in frequency of less choosy females. The resulting destabilization of the genetic system provides the milieu for new genetic variants to arise providing the recipe for speciation to occur. Eventually, a growth in population size paired with novel female mate preferences will give rise to reproductive isolation from the main population-thereby completing the speciation process.[11] Support for this model comes from experiments and observation of species that exhibit asymmetric mating patterns such as the Hawaiian Drosophila species[31][32] or the Hawaiian cricket Laupala.[33] However, while laboratory experiments are ongoing and yet to be completed in support of the model, there are field observations of shifts in the mating systems that undergo population bottlenecks which demonstrate that the dynamics of sexual selection is occurring in nature and therefore, it does represent a plausible process of peripatric speciation that takes place in nature.[12] |
モデル 周辺個体群 周辺個体群による種分化モデルは、隔離種分化モデル(allopatric speciation)と同じである。[1]:105 地理的な隔離と時間が必要な種分化は、予測可能な副産物として生じる可能性がある。[13] 周辺個体群による種分化は、以下の3つの主な特徴によって隔離種分化と区別できる。[1]:105 隔離された個体群の規模 新規環境への分散と定着による強い選択、 小規模な個体群における遺伝的浮動の影響 個体群の規模は重要である。なぜなら、新しい生息地に定着する個体は、おそらく元の個体群の遺伝的多様性のほんの一部のサンプルしか含まないからである。 これは、強い選択圧による分化を促進し、子孫の個体群内で対立遺伝子が急速に固定される。これにより、遺伝的不適合が進化する可能性が生じる。この不適合 が生殖隔離を引き起こし、時には急速な種分化が起こる。[1]: 105 さらに、地質学的または気候の変化により個体群が局所的に分断化される(異所的種分化を考慮する場合は地域的に)こと、および隔離された個体群の生殖形質 が十分に進化し、潜在的な二次接触時に交雑が妨げられるという、2つの重要な予測が導かれる。[14] 周辺個体群モデルでは、派生種(周辺的に孤立した個体群)が地理的にも遺伝的にも祖先種から隔離され、派生種が分化する。派生種と祖先種は、周辺個体群モ デルの結果、祖先種派生種と呼ばれる種ペアとなる。[15] 特定の系統発生学的特徴は、この種の分化の様式から生じる。地理的に広く分布する祖先種は、派生種(周辺個体群)との関係で側系統(パラフィティレイト) となる(したがって、パラスペシスとなる)。 派生種(周辺隔離種)に関して、地理的に隔離された祖先種は側系統(パラフィティリー)となる。[1]: 470 パラフィティリーの概念は、進化論上の種概念の論理的帰結であり、それによって1つの種から派生種が生じる。[16] 周辺隔離種の形質特性はアポモルフィックになると考えられているが、中心集団はプレシオモルフィックのままである。[17] 現代的クラドスティック法では、種分化が起こるときには元の種はもはや存在せず、2つの新しい種が生まれるという前提でクレードを定義することで、派生種 を偶然に除外する定義が開発された。これは、周辺種分化では当てはまらない。 。マイヤーは、この考え方は種を分類上の地位から失わせるとして、これに警告を発した。[18] ローレン・H・リーゼバーグとリュック・ブルイユは、植物分類学においても同じジレンマが存在することを認識していた。[19] 量子と新種分化 植物学者のバーン・グラントは、J. T. グリック(半隔離状態における種の変異に関する観察)、ソウォール・ライト(遺伝的浮動のモデル)、マイル(周辺個体群モデルと遺伝的革命モデルの両 方)、ジョージ・ゲイロード・シンプソン(量子進化の概念の展開)の考えを組み合わせた「量子進化」という用語を提案した。[ 20]: 114 量子種分化は、遺伝子型または表現型に大きな影響を及ぼす急速なプロセスであり、これにより、より大きな集団から、交雑する新しい植物種が半隔離された周 辺集団として分岐する。[21][20]: 114 交雑と遺伝的浮動は、個体数の減少により起こり、 適応度の低さから、絶滅につながるゲノムの変化が起こる可能性が高い。[20]: 115 まれなケースではあるが、適応度を持つ染色体形質が現れる場合もあり、その結果、派生種である新たな種が誕生することもある。[9][22] この種の種分化の証拠は、いくつかの植物種ペアで発見されている。レイア・ディスコイデアとレイア・ガンドロサ、クラークイア・リンガタとクラークイア・ ビロバ、ステファノメリア・マリウレンシスとステファノメリア・エクィガ・サブスピー・コロナリアである。 周辺種分化のモデルとして、新種分化が密接に関連している。これは主に植物の種分化の文脈で用いられている。[23] 新種が祖先種の分布域の周辺で発生する新種分化プロセスは、植物では一般的であると考えられている[23]。特に、祖先種から派生した種同士では一般的で ある。[24] 遠心性種分化 ウィリアム・ルイス・ブラウン・ジュニアは、1957年に周辺種分化の代替モデルとして「遠心性種分化」を提唱した。このモデルは、生殖的隔離につながる 遺伝的変異の起源という点で、周辺種分化説とは対照的である。[25] ある種の個体群は、地理的分布の拡大期を経て縮小期を迎える。縮小期には、個体群の断片が中心個体群の周辺に小さな避難個体群として孤立する。中心個体群 は規模が大きく、遺伝的多様性も潜在的に高いことから、突然変異が起こりやすい。これらの突然変異は孤立した周辺集団に残り、生殖的隔離を促進する。その 結果、ブラウンは、別の拡大期には中心集団が周辺集団を圧倒し、種の分化を妨げると示唆した。しかし、その種が特殊化した生態的地位を見つけた場合、2つ の集団は共存できる可能性がある。[26][27] このモデルの系統発生上の特徴は、中心集団が派生型になる一方で、周辺集団の孤立型は始原型にとどまることである。[17]これは一般的なモデルとは逆で ある。遠心性種分化とは対照的に、周辺種分化は求心性種分化と呼ばれることもある(対比については図1および2を参照)[28]。遠心性種分化は、 科学文献ではほとんど無視され、しばしば従来の周辺種分化モデルが支配的であった。[29][25][17] にもかかわらず、ブラウンは自身のモデルを裏付ける多くの証拠を引用しており、その証拠はまだ反論されていない。[26] ペロミスクス・ポリオノータスとP.メラノティス(P.マニクラタスの中央集団から周辺的に孤立した種)は、遠心分離型種分化モデルによって生じた。 [30] 遠心分離型種分化は、ツリーカンガルー、南米のカエル(ツノガエル属)、トガリネズミ (Crocidura)、および霊長類(Presbytis melalophos)で起こった可能性がある。[29] ジョン・C・ブリッグスは、遠心性種分化を起源中心と関連づけ、遠心性モデルがインド洋西部の「起源中心」から提案された種パターンを引用し、データによ り裏付けられていると主張している。[29] カネシロ・モデル  カネシロ・モデルでは、大きな個体群のサンプルが、メスが受容性を示す閾値を下げることのできるオスの数が少ない孤立した個体群を生み出す。 時間が経つにつれ、選択の厳しいメスは淘汰され、選択の厳しくないメスの頻度が高まり、個体群の遺伝子頻度に変化が生じる。このような状態は、遺伝的に「不安定」な状態をもたらし、新たな遺伝的変異が生じることを可能にする。新しい生息地により適応した新たな変異体が選択され、やがて、周辺個体群の遺伝的構成は、古い個体群から生殖的に隔離されるほどに変化する可能性がある。 カネシロモデルは、エルンスト・マイヤーとハンプトン・カーソンが提唱した創始者イベントにおける種の分化のメカニズムについても説明している。多くの場 合、単一の受精雌が偶然に全く異なる場所、例えばハワイ諸島のような列島中の隣接する島に移動し、少数の子孫を残すことで、創始者イベントが起こる。この ような創始者コロニーは、金城モデルで説明されているように、極めて小さな個体数に直面し、交配システムが変化し、より選択の余地のない雌の割合が増加す る。その結果、遺伝システムが不安定化し、新たな遺伝的変異が生じる環境が整い、種分化が起こる条件が整う。最終的に、個体数の増加と新たなメスの交尾相 手への好みが組み合わさり、主要な個体群から生殖的に孤立し、それによって種分化プロセスが完了する。[11] このモデルの裏付けは、ハワイのショウジョウバエ[31][32]やハワイコオロギLaupala[ しかし、このモデルを裏付ける実験室での実験は現在も継続中であり、まだ完了していないが、個体群のボトルネックを経験した交配システムの変化に関する野 外観察結果から、自然界で性淘汰の力学が起こっていることが証明されており、したがって、これは自然界で起こる周辺種分化の妥当なプロセスであると考えら れる。[12] |
| Evidence See also: Allopatric speciation § Observational evidence Observational evidence and laboratory experiments support the occurrence of peripatric speciation. Islands and archipelagos are often the subject of speciation studies in that they represent isolated populations of organisms. Island species provide direct evidence of speciation occurring peripatrically in such that, "the presence of endemic species on oceanic islands whose closest relatives inhabit a nearby continent" must have originated by a colonization event.[1]: 106–107 Comparative phylogeography of oceanic archipelagos shows consistent patterns of sequential colonization and speciation along island chains, most notably on the Azores islands, Canary Islands, Society Islands, Marquesas Islands, Galápagos Islands, Austral Islands, and the Hawaiian Islands—all of which express geological patterns of spatial isolation and, in some cases, linear arrangement.[34] Peripatric speciation also occurs on continents, as isolation of small populations can occur through various geographic and dispersion events. Laboratory studies have been conducted where populations of Drosophila, for example, are separated from one another and evolve in reproductive isolation. Hawaiian archipelago  Colonization events of species from the genus Cyanea (green) and species from the genus Drosophila (blue) on the Hawaiian island chain. Islands age from left to right, (Kauai being the oldest and Hawaii being the youngest). Speciation arises peripatrically as they spatiotemporally colonize new islands along the chain. Lighter blue and green indicate colonization in the reverse direction from young-to-old.  A map of the Hawaiian archipelago showing the colonization routes of Theridion grallator superimposed. Purple lines indicate colonization occurring in conjunction with island age where light purple indicates backwards colonization. T. grallator is not present on Kauai or Niihau so colonization may have occurred from there, or the nearest continent. 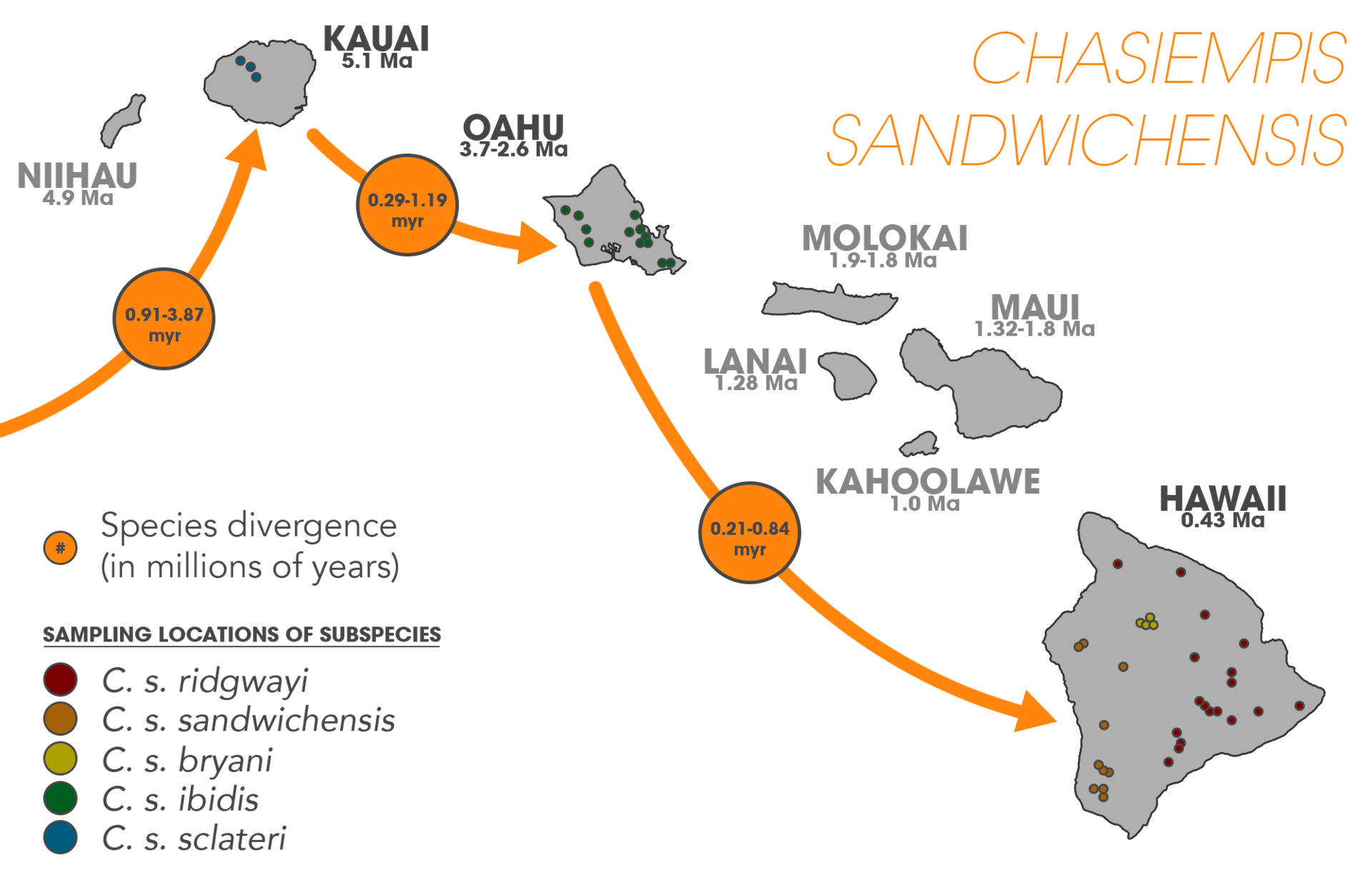 The sequential colonization and speciation of the ‘Elepaio subspecies along the Hawaiian island chain. Drosophila species on the Hawaiian archipelago have helped researchers understand speciation processes in great detail. It is well established that Drosophila has undergone an adaptive radiation into hundreds of endemic species on the Hawaiian island chain;[1]: 107 [35] originating from a single common ancestor (supported from molecular analysis).[36] Studies consistently find that colonization of each island occurred from older to younger islands, and in Drosophila, speciating peripatrically at least fifty percent of the time.[1]: 108 In conjunction with Drosophila, Hawaiian lobeliads (Cyanea) have also undergone an adaptive radiation, with upwards of twenty-seven percent of extant species arising after new island colonization—exemplifying peripatric speciation—once again, occurring in the old-to-young island direction.[37][38][39] Other endemic species in Hawaii also provide evidence of peripatric speciation such as the endemic flightless crickets (Laupala). It has been estimated that, "17 species out of 36 well-studied cases of [Laupala] speciation were peripatric".[1]: 108 [40] Plant species in genera's such as Dubautia, Wilkesia, and Argyroxiphium have also radiated along the archipelago.[41] Other animals besides insects show this same pattern such as the Hawaiian amber snail (Succinea caduca),[42] and ‘Elepaio flycatchers.[43] Tetragnatha spiders have also speciated peripatrically on the Hawaiian islands,[44][45] Numerous arthropods have been documented existing in patterns consistent with the geologic evolution of the island chain, in such that, phylogenetic reconstructions find younger species inhabiting the geologically younger islands and older species inhabiting the older islands[46] (or in some cases, ancestors date back to when islands currently below sea level were exposed). Spiders such as those from the genus Orsonwelles exhibit patterns compatible with the old-to-young geology.[47] Other endemic genera such as Argyrodes have been shown to have speciated along the island chain.[48] Pagiopalus, Pedinopistha, and part of the family Thomisidae have adaptively radiated along the island chain,[49] as well as the wolf spider family, Lycosidae.[50] A host of other Hawaiian endemic arthropod species and genera have had their speciation and phylogeographical patterns studied: the Drosophila grimshawi species complex,[51] damselflies (Megalagrion xanthomelas and Megalagrion pacificum),[52] Doryonychus raptor, Littorophiloscia hawaiiensis, Anax strenuus, Nesogonia blackburni, Theridion grallator,[53] Vanessa tameamea, Hyalopeplus pellucidus, Coleotichus blackburniae, Labula, Hawaiioscia, Banza (in the family Tettigoniidae), Caconemobius, Eupethicea, Ptycta, Megalagrion, Prognathogryllus, Nesosydne, Cephalops, Trupanea, and the tribe Platynini—all suggesting repeated radiations among the islands.[54] Other islands Phylogenetic studies of a species of crab spider (Misumenops rapaensis) in the genus Thomisidae located on the Austral Islands have established the, "sequential colonization of [the] lineage down the Austral archipelago toward younger islands". M. rapaensis has been traditionally thought of as a single species; whereas this particular study found distinct genetic differences corresponding to the sequential age of the islands.[55] The figwart plant species Scrophularia lowei is thought to have arisen through a peripatric speciation event, with the more widespread mainland species, Scrophularia arguta dispersing to the Macaronesian islands.[56][57] Other members of the same genus have also arisen by single colonization events between the islands.[58][59] Species patterns on continents  The southern chestnut-tailed antbird, Sciaphylax hemimelaena  Satellite image of the Noel Kempff Mercado National Park (outlined in green) in Bolivia, South America. The white arrow indicates the location of the isolated forest fragment. The occurrence of peripatry on continents is more difficult to detect due to the possibility of vicariant explanations being equally likely.[1]: 110 However, studies concerning the Californian plant species Clarkia biloba and C. lingulata strongly suggest a peripatric origin.[60] In addition, a great deal of research has been conducted on several species of land snails involving chirality that suggests peripatry (with some authors noting other possible interpretations).[1]: 111 The chestnut-tailed antbird (Sciaphylax hemimelaena) is located within the Noel Kempff Mercado National Park (Serrania de Huanchaca) in Bolivia. Within this region exists a forest fragment estimated to have been isolated for 1000–3000 years. The population of S. hemimelaena antbirds that reside in the isolated patch express significant song divergence; thought to be an "early step" in the process of peripatric speciation. Further, peripheral isolation "may partly explain the dramatic diversification of suboscines in Amazonia".[14] The montane spiny throated reed frog species complex (genus: Hyperolius) originated through occurrences of peripatric speciation events. Lucinda P. Lawson maintains that the species' geographic ranges within the Eastern Afromontane Biodiversity Hotspot support a peripatric model that is driving speciation; suggesting that this mode of speciation may play a significant role in "highly fragmented ecosystems".[2] In a study of the phylogeny and biogeography of the land snail genus Monacha, the species M. ciscaucasica is thought to have speciated peripatrically from a population of M. roseni. In addition, M. claussi consists of a small population located on the peripheral of the much larger range of M. subcarthusiana suggesting that it also arose by peripatric speciation.[61]  Foliage and cones of Picea mariana  Foliage and cones of Picea rubens Red spruce (Picea rubens) has arisen from an isolated population of black spruce (Picea mariana). During the Pleistocene, a population of black spruce became geographically isolated, likely due to glaciation. The geographic range of the black spruce is much larger than the red spruce. The red spruce has significantly lower genetic diversity in both its DNA and its mitochondrial DNA than the black spruce.[62][63] Furthermore, the genetic variation of the red spruce has no unique mitochondrial haplotypes, only subsets of those in the black spruce; suggesting that the red spruce speciated peripatrically from the black spruce population.[64][65][66] It is thought that the entire genus Picea in North America has diversified by the process of peripatric speciation, as numerous pairs of closely related species in the genus have smaller southern population ranges; and those with overlapping ranges often exhibit weak reproductive isolation.[67][63] Using a phylogeographic approach paired with ecological niche models (i.e. prediction and identification of expansion and contraction species ranges into suitable habitats based on current ecological niches, correlated with fossil and molecular data), researchers found that the prairie dog species Cynomys mexicanus speciated peripatrically from Cynomys ludovicianus approximately 230,000 years ago. North American glacial cycles promoted range expansion and contraction of the prairie dogs, leading to the isolation of a relic population in a refugium located in the present day Coahuila, Mexico.[68] This distribution and paleobiogeographic pattern correlates with other species expressing similar biographic range patterns[68] such as with the Sorex cinereus complex.[69] 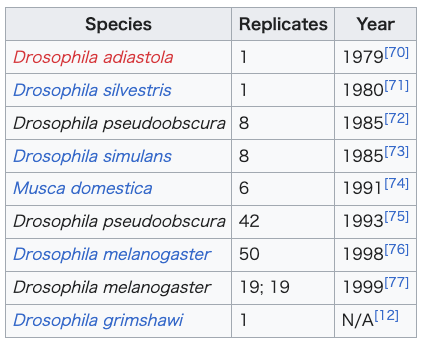 Laboratory experiments See also: Laboratory experiments of speciation Peripatric speciation has been researched in both laboratory studies and nature. Jerry Coyne and H. Allen Orr in Speciation suggest that most laboratory studies of allopatric speciation are also examples of peripatric speciation due to their small population sizes and the inevitable divergent selection that they undergo.[1]: 106 Much of the laboratory research concerning peripatry is inextricably linked to founder effect research. Coyne and Orr conclude that selection's role in speciation is well established, whereas genetic drift's role is unsupported by experimental and field data—suggesting that founder-effect speciation does not occur.[1]: 410 Nevertheless, a great deal of research has been conducted on the matter, and one study conducted involving bottleneck populations of Drosophila pseudoobscura found evidence of isolation after a single bottleneck.[78][79] The table is a non-exhaustive table of laboratory experiments focused explicitly on peripatric speciation. Most of the studies also conducted experiments on vicariant speciation as well. The "replicates" column signifies the number of lines used in the experiment—that is, how many independent populations were used (not the population size or the number of generations performed).[12] |
証拠 参照:隔地種分化 § 観察による証拠 観察による証拠と実験室での実験は、周縁種分化の発生を裏付けている。島や列島は、生物の孤立した個体群を表すことから、種分化の研究対象となることが多 い。島嶼の固有種は、海洋島に最も近縁な種が近隣の大陸に生息していることから、周縁的種分化が起こっているという直接的な証拠を提供しており、これは 「植民地化による出来事によって生じたに違いない」とされている。[1]:106–107 海洋列島の比較系統地理学では、島列に沿って順次植民地化と種分化が起こるという一貫したパターンが示されている。特にアゾレス諸島、カナリア諸島、ソシ エテ諸島、マルケサス諸島、ガラパゴス諸島、オーストラル諸島、ハワイ諸島などでは、地質学的な空間分離のパターンが示されており、場合によっては直線的 な配列も見られる。[34] 地理的な分離や分散のさまざまな事象により、小規模な個体群が孤立することがあるため、周辺種分化は大陸でも起こりうる。例えば、ショウジョウバエの個体 群を互いに隔離し、生殖的隔離の中で進化させる実験室での研究が行われている。 ハワイ諸島  ハワイ諸島におけるCyanea属(緑)とDrosophila属(青)の種の植民地化。 左から右に向かって島が古くなり、(カウアイ島が最も古く、ハワイ島が最も新しい)種分化は、時空的に新しい島々を植民地化するにつれて周辺的に発生す る。 薄い青と緑は、若い島から古い島への逆方向の植民地化を示す。  ハワイ諸島の地図に、Theridion grallatorの植民化ルートを重ねて表示したもの。紫色の線は、島の年齢に伴って起こる植民化を示しており、薄紫色は逆方向の植民化を示している。 T. grallatorはカウアイ島やニイハウ島には生息していないため、これらの島々から植民化が起こったか、あるいは最も近い大陸から植民化が起こった可 能性がある。  ハワイ諸島における「エレパイオ亜種」の順次移住と種分化。 ハワイ諸島におけるショウジョウバエの種は、研究者が種の分化プロセスを詳細に理解するのに役立っている。ショウジョウバエがハワイ諸島で数百種もの固有 種へと適応放散したことはよく知られている。[1]: 107 [35] それらは単一の共通祖先(分子解析により裏付けられている)から発生した。[36] 研究では、各島の植民地化は古い島から新しい島へと起こったことが一貫して示されており、ショウジョウバエでは、少なくとも50%は周辺で種分化している ことが分かっている。。ショウジョウバエと関連して、ハワイのヒゲナガミジンコ(Cyanea)もまた適応放散を経験しており、現存する種の27パーセン ト以上が新しい島への移住後に誕生したもので、この場合もまた、周縁種分化が起こっている。 ハワイの固有種である飛べないコオロギ(Laupala)も、周辺種分化の証拠を提供している。よく研究されているLaupalaの36の種分化事例のう ち、17の種が周辺種分化である」と推定されている。[1]:108[40] デュボアシア属(Dubautia)、ウィルキシア属(Wilkesia)、アルギロキシフィウム属(Argyroxiphium)などの属に属する植物 種も 属、および Argyroxiphium 属の植物種も、列島に沿って分岐している。[41] ハワイアン・アンバー・スネイル(Succinea caduca)などの昆虫以外の動物にも、この同じパターンが見られる。[42] また、「エレパイオ・フライキャッチャー」もそうだ。[43] ハワイ諸島では、テトラニータ蜘蛛も周辺で種分化している[44][45]。多数の節足動物が、島々の地質学的進化と一致するパターンで存在していること が記録されている。系統発生の再構築では、地質学的に若い島々には若い種が、古い島々には古い種が生息していることが分かっている[46](または、一部 のケースでは、現在海面下にある島々が露出していた時代にまで祖先を遡ることができる)。オズモウェルス属(Orsonwelles)などのクモは、古い 島から若い島へと適応したパターンを示している。[47] アルギロデス属(Argyrodes)などの他の固有属は、島々をたどって種分化してきたことが示されている。[48] パギオパルス属(Pagiopalus)、ペディノピスタ属(Pedinopistha)、トミシダ科(Thomisidae)の一部は、島々をたどって 適応放散してきた。[49] オオヒメグモ科(Lycosidae)も同様である。[50] ハワイ固有の節足動物種や属の多くは、その種分化や系統地理学的なパターンが研究されている。the Drosophila grimshawi species complex,[51] damselflies (Megalagrion xanthomelas and Megalagrion pacificum),[52] Doryonychus raptor, Littorophiloscia hawaiiensis, Anax strenuus, Nesogonia blackburni, Theridion grallator,[53] Vanessa tameamea, Hyalopeplus pellucidus, Coleotichus blackburniae, Labula, Hawaiioscia, Banza (in the family Tettigoniidae), Caconemobius, Eupethicea, Ptycta, Megalagrion, Prognathogryllus, Nesosydne, Cephalops, Trupanea, and the tribe Platynini—all suggesting repeated radiations among the islands.[54] その他の島々 オーストラリア諸島に生息するトミス科のカニグモの一種(Misumenops rapaensis)の系統発生学的研究により、「オーストラリア諸島で若い島々に向かって系統が順次入植した」ことが証明された。M. rapaensisは従来単一種と考えられてきたが、この特定の研究では、島々の年代順に明確な遺伝的差異が認められた。[55] フィグワート植物の一種であるScrophularia loweiは、 種分化イベントによって生じたと考えられており、より広範囲に分布する本土の種である Scrophularia arguta がマカロネシア諸島に分散したと考えられている。[56][57] 同じ属の他の種も、諸島間の単一の植民地化イベントによって生じたと考えられている。[58][59] 大陸における種の分布  南栗尾蟻鳥(学名:Sciaphylax hemimelaena)  南米ボリビアのノエル・ケンプ・メルカード国立公園(緑線で囲まれた部分)の衛星画像。白い矢印は孤立した森林断片の位置を示している。 大陸における周遊の発生は、隔地説の説明が同様に可能であるため、発見がより困難である。[1]:110 しかし、カリフォルニアの植物種クラークニア・ビロバとクラークニア・リンガタに関する研究は、 辺縁起源を示唆している。[60] さらに、キラル性を伴う陸生巻貝のいくつかの種を対象に、辺縁起源を示唆する多くの研究が行われている(一部の著者は、他の可能性のある解釈を指摘してい る)。[1]: 111 クリイロハリアリドリ(Sciaphylax hemimelaena)は、ボリビアのノエル・ケンプ・メルカード国立公園(Serrania de Huanchaca)に生息している。この地域には、1000年から3000年前に孤立したと推定される森林の断片が存在する。孤立した地域に生息する S. hemimelaenaアリドリの個体群は、著しい歌の分化を示しており、周辺種分化の「初期段階」であると考えられている。さらに、周辺部の孤立は、 「アマゾンの亜鳴禽類の劇的な多様化を部分的に説明できるかもしれない」[14]。 山地のトゲノドヨシガエル種群(属:ハイペリウス)は、周辺種分化事象の発生により誕生した。 ルシンダ・P・ローソンは、アフリカ東部山地生物多様性ホットスポット内のこの種の地理的分布は、周辺種分化モデルを裏付け、それが種分化を推進している と主張している。この種の分化の様式は、「高度に断片化された生態系」において重要な役割を果たしている可能性があることを示唆している。[2] カタツムリの一属であるモナカ属の系統発生と生物地理学に関する研究では、M. ciscaucasicaという種はM. roseniの個体群から周縁的種分化したと考えられている。さらに、M. claussiは、M. subcarthusianaのより広大な生息域の周辺に位置する小さな個体群から構成されており、これも周縁的種分化によって生じたことを示唆してい る。[61]  マツ科マリアナトウヒ属の葉と球果  マツ科ルベントウヒ属の葉と球果 ベニトウヒ(Picea rubens)は、アメリカトウヒ(Picea mariana)の孤立した個体群から進化した。 更新世の時代に、アメリカトウヒの個体群が氷河作用によって地理的に孤立したと考えられる。黒色トウヒの地理的範囲は、赤色トウヒよりもはるかに広い。 赤色トウヒは、そのDNAおよびミトコンドリアDNAの両方において、黒色トウヒよりも遺伝的多様性が著しく低い。[62][63] さらに、赤色トウヒの遺伝的多様性には、黒色トウヒのそれらとは異なるミトコンドリアハプロタイプは存在せず、黒色トウヒのサブセットのみである。このこ とは、赤色トウヒが黒色トウヒの個体群から周辺種分化したことを示唆している。。北米のトウヒ属全体が、周辺種分化のプロセスによって多様化したと考えら れている。同属の近縁種は南部の個体群の範囲が狭く、また、分布域が重複する種は生殖的隔離が弱いことが多い。 系統地理学的アプローチと生態学的ニッチモデル(すなわち、現在の生態学的ニッチに基づいて、化石および分子データと相関させた、適した生息地における種 の拡大・縮小範囲の予測と特定)を組み合わせた手法により、研究者は、草原犬の一種であるCynomys mexicanusが、約23万年前にCynomys ludovicianusから周辺種分化したことを発見した。北米の氷河期のサイクルはプレーリードッグの生息域の拡大と縮小を促進し、メキシコの現在の コアウイラ州にある避難地に遺存種が孤立する結果となった。[68] この分布と古生物地理学上のパターンは、Sorex cinereus 複合体など、同様の生物地理学的範囲パターンを示す他の種と相関している。[68][69]  実験室での実験 関連情報: 種分化の実験室実験 周辺個体群における種分化は、実験室での研究と自然界の両方で研究されている。ジェリー・コインとH.アレン・オーによる『種分化』では、異所的種分化に 関する実験室での研究のほとんどは、個体群が小さく、不可避的に分岐選択を受けることから、周辺個体群における種分化の例でもあると示唆している。 [1]: 106 周辺個体群に関する実験室での研究の多くは、創始者効果の研究と密接に関連している。コインとオーは、種の分化における選択の役割は十分に確立されている が、遺伝的浮動の役割は実験データやフィールドデータでは裏付けられておらず、創始者効果による種の分化は起こらないことを示唆していると結論づけてい る。[1]: 410 しかし、この問題については多くの研究が行われており、ショウジョウバエの一種であるキイロショウジョウバエのボトルネック個体群を対象としたある研究で は、単一のボトルネック後に隔離の証拠が見つかっている。[78][79] この表は、周辺個体群分化に明確に焦点を当てた実験室での実験の抜粋である。ほとんどの研究では、隔離種分化に関する実験も行われている。「複製」の列 は、実験で使用された系統数、すなわち、独立した個体群がいくつ使用されたかを意味する(個体群の規模や世代数ではない)。[12] |
| https://en.wikipedia.org/wiki/Peripatric_speciation |
|
June 1928: Ernst Mayr with Sario, one of his Malay assistants, in the former Dutch New Guinea. Mayr led ornithological expeditions to Dutch New Guinea and German Mandated New Guinea, an experience that fulfilled “the greatest ambition of his youth.” Mayr collected ca. 7000 bird skins in two and a half years.
1928
年6月:オランダ領ニューギニアにいた頃のマレー人の助手、サリオとエルンスト・マイル。マイルはオランダ領ニューギニアとドイツ委任統治領ニューギニア
で鳥類学探検隊を率いたが、それは「青年時代の最大の野望」を成就させる経験となった。マイルは2年半の間に約7000羽の鳥の剥製を集めた。
リ ンク
文 献
そ の他の情報
Copyleft, CC, Mitzub'ixi Quq Chi'j, 1996-2099
☆
 ☆
☆