依存症の分子メカニズム
Molecular mechanisms of the addiction

核内側前頭前野における精神刺激薬依存症を引き起こすシグナル伝達カスケード
★依存症は、実質的な害やその他の否定的な結果にもかかわらず、薬物を使 用したり、自然な報酬をもたらす行動に関与したりしたいという持続的で強い衝動を特徴とする神経心理学的障害である。薬物の反復使用は、食物や恋愛のような自然な報酬と同様に、シ
ナプスにおける脳機能を変化させ、渇望を持続させ、既存の脆弱性を持つ人々の自制心を弱める。この現象——薬物が脳機能を再形成する——は、依存症の発症
に関与する神経生物学的要因だけでなく、複雑で多様な心理社会的要因を伴う脳疾患としての依存症の理解につながっている。
☆「依存症の分子・遺伝的メカニズム研究」より再掲、ほか。
| 依存症の発現の分子的あるいは遺伝的メカニズムについてどんな先行研究がありますか? |
依存症は、薬物や行動に対する制御不能な渇望と使用を特徴とする複雑な疾患であり、その発現には遺伝的要因、環境要因、およびそれらの相互作用が深く関与している。分子レベル、遺伝子レベルでのメカニズム解明に向けて、多くの先行研究が行われている。 以下に主な研究領域と具体的な研究例を挙げよう。 |
| 1. 神経伝達物質システムと関連分子 |
依存症は、脳の報酬系、特にドーパミンシステムに深く関連している。薬物や依存性のある行動は、この報酬系を活性化し、ドーパミンの放出を促すことで快感をもたらす[と考えられている]。 |
| ドーパミンシステム: |
・
ドーパミン神経活動の変化:
覚醒剤などの薬物投与は、腹側被蓋野から側坐核に投射するドーパミン神経が放出するドーパミン濃度を上昇させることが知られている。うつ状態でもこの
ドーパミン神経の発火頻度が上がることが報告されており、ストレスと依存症の関連性が示唆されている。 ・ドーパミン受容体: ドーパミンD1/D3レセプターの機能変化や、D2/3受容体結合および前シナプスのドーパミン放出の低下などが、薬物依存症患者で報告されている。 ・Npas4: Npas4というタンパク質が報酬(快感)関連行動・記憶を制御する分子メカニズムが解明されており、薬物依存症などの脳内報酬系回路が関与する精神・神経疾患の病態解明や治療法開発への応用が期待されている。 |
| その他の神経伝達物質システム: |
・グルタミン酸神経系、GABA神経系、エンドカンナビノイドシステム: これらのシステムも依存症の形成に関わることが示唆されており、これらの神経系分子が依存症治療薬のターゲットとなる可能性もある。 ・Shati/Nat8l: 覚醒剤依存関連分子としてShati/Nat8lが注目されており、その発現変化が海馬で確認されている。 |
| 2. 遺伝的要因と遺伝子多型 |
個人の遺伝的背景は、依存症の発症リスクや薬物への感受性に大きく影響する。 |
| 遺伝子多型: |
・特定の薬物代謝酵素(例: CYP2C9)や薬物作用の標的分子(例: VKORC1)の遺伝子多型が、薬物の効果や副作用、依存性薬物への感受性に関連することが報告されている。これはファーマコゲノミクスという分野で研究が進められている。 ・NrCAM: 神経接着因子であるNrCAMは、依存症関連遺伝子として先行研究で明らかになっており、依存の形成における脳神経ネットワークの構築に関わる可能性が指 摘されている。Nrcam遺伝子の低発現の有無や、覚せい剤依存形成前後での神経関連分子群の変化が調べられている。 ・CREB遺伝子多型: 依存性薬物感受性や依存症脆弱性におけるCREB遺伝子多型の役割も研究されている。 ドーパミン関連遺伝子: ドーパミン受容体やドーパミントランスポーターの遺伝子多型が、依存症のリスクや行動特性と関連することが示唆されている。 |
| 3. エピジェネティクス |
遺伝子配列の変化ではなく、DNAのメチル化やヒストン修飾といった後天的な遺伝子発現調節(エピジェネティクス)も依存症の発現に重要な役割を果たすことが近年注目されている。 |
| DNAメチル化: |
・脳内のDNAメチル化の変化が、ストレス耐性や認知・社会的機能といった行動的側面、形態・生理的反応に影響を与え、精神疾患の発症脆弱性に繋がる可能性が示唆されている。 ・特定の遺伝子(例: セロトニントランスポーターSLC6A4)のDNAメチル化変化が、気分障害や統合失調症患者で報告されており、依存症においても同様のメカニズムが関与する可能性がある。 ・発達期における脳内DNAメチル化の変化が、成長後の精神疾患発症脆弱性に繋がるという仮説に基づいた研究も行われている。 |
| ヒストン修飾: |
ヒストン修飾異常も、がん細胞などでのエピジェネティクス制御機構として注目されており、依存症においても遺伝子発現調節に影響を与える可能性が考えられる。 |
| 4. 神経回路と脳構造の変化 |
依存症は、脳の特定の神経回路、特に報酬系、意思決定、抑制に関わる前頭前野などに構造的・機能的な変化を引き起こす。 |
| ・脳神経ネットワークの再構築: 依存の形成において、脳神経ネットワークの再構築が起こることが示唆されており、NrCAMのような神経接着因子がその過程に関与する可能性がある。 ・大麻の脳への影響: 大麻の有効成分であるカンナビノイドが、大脳皮質の神経回路形成に悪影響を与え、神経投射の退縮を引き起こすことが報告されている。 |
|
| 総論 |
これらの先行研究は、依存症が単一のメカニズムで発現するのではなく、
複数の分子、遺伝子、および脳領域の複雑な相互作用によって引き起こされる多因子疾患であることを示唆している。これらのメカニズムをさらに解明するこ
とで、依存症の予防、診断、そして個別化された治療法の開発に繋がることが期待されている。 |
★コカインを峻別するショウジョウバエ
| J Neurosci . 2025 Jun 2:e1040242025. doi: 10.1523/JNEUROSCI.1040-24.2025. Online ahead of print. Bitter sensing protects Drosophila from developing experience-dependent cocaine consumption preference Travis J Philyaw 1 2, Iris Titos 3, Pearl N Cummins-Beebee 4, Aylin R Rodan 3 5 6 7, Adrian Rothenfluh 8 3 4 7 9 Affiliations Expand PMID: 40456609 DOI: 10.1523/JNEUROSCI.1040-24.2025 |
コカインは依存性がある精神刺激薬であり、コカイン使用障害(CUD)
を発症するリスクは遺伝性が高い。CUD の発症につながる特定の遺伝子やメカニズムについてはほとんど知られておらず、現在、FDA
が承認した治療薬はない。ショウジョウバエは、依存症、特にアルコール使用障害の根底にある遺伝子やメカニズムを特定するための有効なモデル生物であるこ
とが証明されている。コカインに曝露されたショウジョウバエは、多動や睡眠の減少など、哺乳類で観察されるような急性中毒の症状を示すが、これまで、ショ
ウジョウバエにおけるコカインの優先的な自己投与のモデルは存在しなかった。そこで、我々は、ショウジョウバエの雄におけるコカインの消費量と、2択パラ
ダイムによる嗜好を測定した。また、遺伝学的手法および画像解析手法を用いて、コカインの味覚感知に関与するメカニズムを調べた。その結果、コカインは
ショウジョウバエにとって生来嫌悪的な物質であり、この回避行動は苦味感知に依存していることが明らかになった。苦味受容体Gr66aを発現する味覚感覚
神経細胞は、コカイン曝露により活性化される。これらの苦味感知神経細胞のサイレンシングまたはGr66aの変異は、コカイン回避を減少させる。縦断的選
択試験において、これらのハエは12〜18時間以内にコカイン含有溶液への選択性を発達させるが、対照群のハエは発達しない。当研究の結果は、苦味感覚が
ハエのコカイン自己投与選択性の発達から保護することを示している。逆に、苦味知覚をサイレンシングすることで、ショウジョウバエを経験依存的なコカイン
自己投与選好のモデルとして利用することが可能になる。これにより、この非常に扱いやすいモデル生物を用いて、CUD
に関連するヒトの変異体がコカイン自己投与の原因となる役割を検証する道が開かれる。意義の声明
コカイン使用障害(CUD)は、遺伝性の強い疾患であり、効果的な治療法はない。CUD
に関連する多くの人間の遺伝的変異を検証するには、費用対効果が高く、遺伝的に扱いやすいモデルが必要だ。ここでは、苦味を感じるニューロンがショウジョ
ウバエのコカインの自己投与を抑制することを示した。さらに、ショウジョウバエの苦味知覚を阻害することで、経験依存的なコカイン嗜好のモデルを構築でき
ることを実証した。我々の発見は、CUD
の根底にある遺伝的メカニズムの解明、新しい治療標的の発見、およびこの遺伝性の高い疾患の効果的な治療法の開発に貢献する、ショウジョウバエの重要な
ツールとしての可能性を強調している。 |
☆
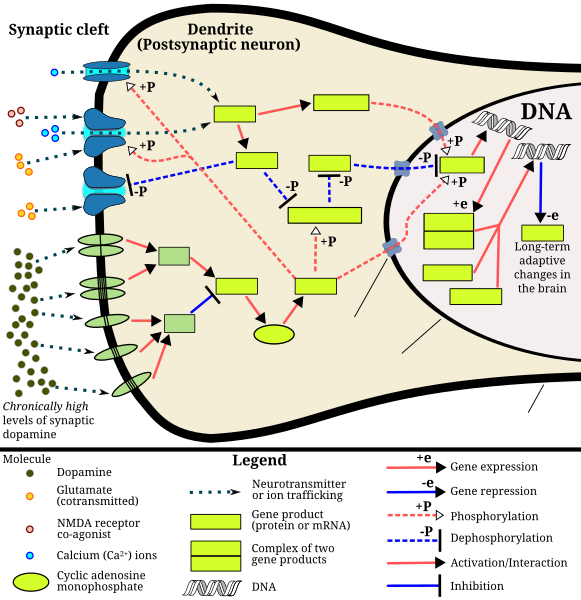
| This diagram depicts
the signaling events in the brain's reward center that are induced by
chronic high-dose exposure to psychostimulants that increase the
concentration of synaptic dopamine, like amphetamine, methamphetamine,
and phenethylamine. Following presynaptic dopamine and glutamate
co-release by such psychostimulants,[80][81] postsynaptic receptors for
these neurotransmitters trigger internal signaling events through a
cAMP-dependent pathway and a calcium-dependent pathway that ultimately
result in increased CREB phosphorylation.[80][82][83] Phosphorylated
CREB increases levels of ΔFosB, which in turn represses the c-Fos gene
with the help of corepressors;[80][84][85] c-Fos repression acts as a
molecular switch that enables the accumulation of ΔFosB in the
neuron.[86] A highly stable (phosphorylated) form of ΔFosB, one that
persists in neurons for 1–2 months, slowly accumulates following
repeated high-dose exposure to stimulants through this process.[84][85]
ΔFosB functions as "one of the master control proteins" that produces
addiction-related structural changes in the brain, and upon sufficient
accumulation, with the help of its downstream targets (e.g., nuclear
factor kappa B), it induces an addictive state.[84][85] |
「この図は、アンフェタミン、メタンフェタミン、フェネチルアミンなど
の心理刺激薬による慢性的な高用量曝露により、脳の報酬系で誘発されるシグナル伝達イベントを示している。このような心理刺激薬によるシナプス前ドーパミ
ンとグルタメートの共放出後[80][81]、これらの神経伝達物質のシナプス後受容体は、cAMP依存性経路とカルシウム依存性経路を通じて内部シグナ
ル伝達イベントを誘発し、最終的にCREBのリン酸化増加を引き起こします。 [80][82][83]
リン酸化されたCREBはΔFosBのレベルを増加させ、ΔFosBはコアプレッサーの助けを借りてc-Fos遺伝子の発現を抑制する;[80]
[84][85] c-Fosの抑制は、神経細胞内でΔFosBの蓄積を可能にする分子スイッチとして機能する。[86]
ΔFosBの高度に安定な(リン酸化された)形態は、刺激物質の反復高用量曝露を通じてこのプロセスを経て、神経細胞内で1〜2ヶ月間持続し、徐々に蓄積
する。[84][85]
ΔFosBは、脳における依存症関連構造変化を引き起こす「主要な制御タンパク質の一つ」として機能し、十分な蓄積量に達すると、下流の標的(例:核因子
カッパB)の助けを借りて依存状態を引き起こす。[84][85]」 |
| https://en.wikipedia.org/wiki/Addiction |
依存症 |
リ ンク
文 献
そ の他の情報
cc
Copyleft, CC, Mitzub'ixi Quq Chi'j, 1996-2099
☆
 ☆
☆