アルツハイマー病
Alzheimer's disease

☆ ア ルツハイマー病(AD)は神経変性疾患であり、通常はゆっくりと始まり徐々に悪化する。 病状が進行すると、言語障害、見当識障害(道に迷いやすいなど)、気分の落ち込み、意欲の喪失、セルフネグレクト、行動上の問題などの症状が現れる。病状 が悪化すると、家族や社会から引きこもることが多くなる。 徐々に身体機能が失われ、最終的には死に至る。進行の速度は様々であるが、診断後の平均余命は3~12年といわれる。
︎マーガレット・ロック著『アルツハイマーの謎』プリンストン大 学出版会、2013年の書評▶︎戦争とアルツハイマー▶︎︎認知症、痴呆症、ぼけ▶︎認知症者に語ることを学ぶこと▶︎︎研究ノート▶アミロイド・マフィア︎▶︎︎ウィリアム・チャールズ・ユテルモーレン▶︎虚構としての認知症▶︎︎老いのパラドックス▶アルツハイマー病の生化学︎▶︎
★ カール・ヘラップ [著] 『ア ルツハイマー病研究、失敗の構造 』梶山あゆみ訳, みすず書房 , 2023.(→「アミロイド・マフィア」よりのインポート)
書 肆による案内文:「一つの仮説に賭けてしまったこの分野の科学の現状。直近数十年の認識自体を問い直す、真摯な総括と告発の書。」
目 次
I.
初めに何があったのか
II.
夢の治療薬はどこへ行った?
III.
両刃の剣
IV. では、ここからどうする?
+++++++++++++++++
| I. 初めに何があったのか |
|
| 1. 患者と家族、市民にとってのアルツハイマー病の歴史 |
・ドロシーの事例(4-) ・世界中にいるドロシーの物語を構想する(11) ・アルツハイマーは進行が遅く、最初の診断から平均10年を要する(16) ・認知症は経済に影響を与える(17-) ・性差、年齢はある、しかし、地域差はない。 ・アルミニウムも携帯電話も発症とは無関係 ・非ステロイド性抗炎症薬は、アルツハイマーの発症を下げる(22-23) ・修道女研究(24) ・生活改善や脳トレは発症予防には効果があるらしい(26-27) |
| 2. 医師にとってのアルツハイマー病の歴史 |
・アウグステ・Dの物語(30-) ・アミロイドプラーク(老人斑)(32-33) ・アルツハイマーモデル、三体モデル、代替モデル、偶然モデル(下図の左)(37)  ・アウグステ・Dの研究は、一個のリンゴを手にとって虫をみつけるのと同じ(39) ・老人斑のあるものが、痴呆状態を示すという、因果論を、一つの事例で、強力に結びつけた。 ・アルツハイマーのリンゴ(41)——老人性の痴呆は、リンゴであり、そのリンゴの痛み方はさまざまな?ということなのか? |
| 3. 科学者にとってのアルツハイマー病の歴史 |
・医師と研究者は異なる(42)——仕事の内容も異なる ・家族性アルツハイマーでは、3つの原因遺伝子がみつかっている(48) ・ただし、孤発性アルツハイマーでは、原因遺伝子はみつかっていない(わからないという表現とどうちがうのか?)(48) ・免疫系の遺伝子ネットワークと関係か?(52) ・アスピリンには効果がないが、イブプロフェンにはリスク低減の効果があるなど(55) ・可能性?;遺伝子?脳の炎症?脂質管理?不適切な小胞管理?(59)遺伝子以外の要因(61)、結局はプラークともつれなのか?(67) |
| 4. 謎が解けた!アルツハイマー病研究を変えた四つの発見 |
・プラークの正体は、アミロイドβ ・親タンパクのAPPから、アミロイドβを切り出す(79)——APPとは、Aβの前駆体タンパク質 (APP)のこと。 ・APPの発見——APPの生成には家族性アルツハイマーの遺伝子が関係(78) 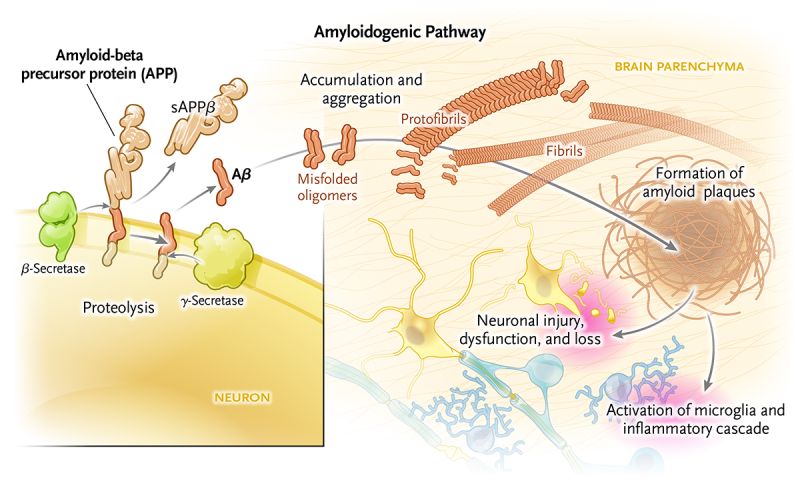 Amyloid-beta (Aβ): A protein derived from the amyloid-beta precursor protein (APP) that is produced in the brain throughout life. Sequential cleavage of this protein by β- and γ-secretases produces two major isoforms of the toxic peptide, amyloid-beta (Aβ40 and Aβ42). Overproduction of APP, which occurs in Down’s syndrome, also drives an excess of Aβ. In older persons and in persons with Alzheimer’s disease, Aβ accumulates in brain parenchyma and blood-vessel walls. These molecules aggregate as misfolded oligomers, which leads to the creation of amyloid plaques. Plaques and soluble Aβ are harmful to neurons and synapses, causing their dysfunction and loss. アミロイドβ(Aβ): アミロイドβ前駆体タンパク質(APP)に由来するタンパク質で、生涯を通じて脳内で産生される。このタンパク質はβセクレターゼとγセクレターゼによっ て順次切断され、毒性ペプチドであるアミロイドβの2つの主要なアイソフォーム(Aβ40とAβ42)が生成される。ダウン症にみられるAPPの過剰産生 もまた、Aβの過剰産生を引き起こす。高齢者やアルツハイマー病患者では、Aβは脳実質や血管壁に蓄積する。これらの分子はミスフォールディングしたオリ ゴマーとして凝集し、アミロイド斑を形成する。プラークと可溶性Aβは神経細胞とシナプスに有害であり、それらの機能障害と喪失を引き起こす。(出典はこちら) ・マウスの脳内のプラークをワクチンによって消失させることができた(90) |
| II. 夢の治療薬はどこへ行った? |
|
| 5. アルツハイマー病病理モデル構築の試み |
・アミロイドカスケードモデルの誕生(101) ・アミロイドカスケード仮説はいじめの手段か?(105-) ・ミエリンの変化とアルツハイマーは関連性ある?(117) ・アルツハイマー病の生化学(127) ・APPとプレセニリンの生化学によりアミロイドβが、アルツハイマー病の発症のグランド・セオリー化した。アミロイドカスケード仮説は、その有力なものとされてる(127) |
| III. 両刃の剣 |
|
| 6. 国による基礎生物医学への支援 |
・アルツハイマーの研究には膨大なお金がかかる(132-)初期投資、実験、その維持管理、そしてDNAシーケンサーや高機能顕微鏡(132-133) ・NIHの予算の推移のグラフ(135) ・高齢化社会への対応への政策との関係や、政府系機関とのあいだの関係(138) ・さらに重要なのは、巨額の利益を生む(利権)構造がある(142)→7章製薬・バイオ産業 ・基礎研究費に割く、連邦予算の表(145) ・「アミロイドの研究でなければアルツハイマー病の研究ではない」とまでに言われる産業化(147) ・NIHのデータベースに関するエピソード(148) |
| 7. 製薬・バイオ産業 |
・製薬・バイオ産業は、研究費への予算を削減して基礎研究は政府系にアウトソースしつつある(151)製薬・バイオ系はその分を応用研究にふりわける。 ・製薬産業が、ブロックバスターをねらう研究体制になっている(151-152) ・オビオイド危機(152) ・インスリン産業(152) ・統計資料は161ページをみよ(原著122-123) ・バイオジェン社の株価の推移(169)——アデュカヌマブ製造会社 |
| 8. モデルの検証と、その無惨な結果 |
・仮説検証(1)——アミロイドを加えてアルツハイマーをつくる(175-) ・マウスモデルは人間のものと対応しない(181) ・仮説検証(2)——アミロイドを取り除いてアルツハイマーを治療する(183) ・仮説検証(3)——アミロイドが形成されないようにする(192) ・検証結果は、アミロイドカスケード仮説は落第(194-) |
| 9. アルツハイマー病とは何だろうか? |
・アルツハイマーの定義が問われている ・痴呆症とそうでない人の、プラークの比較(201) 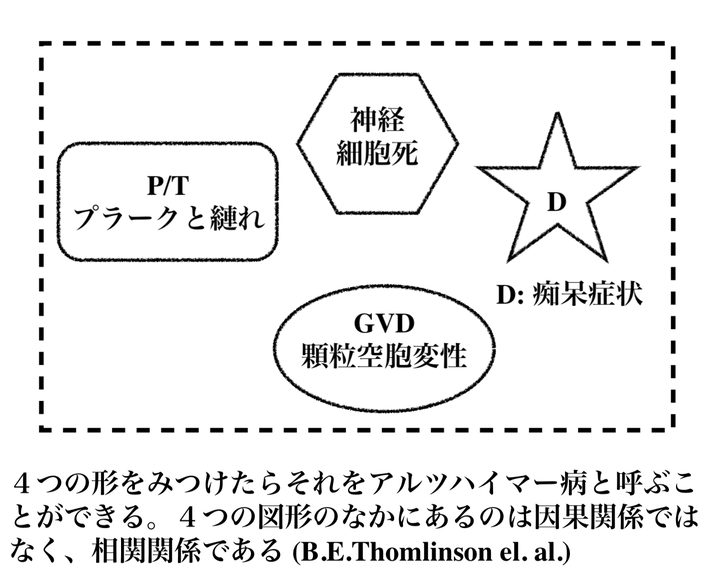 ・アルツハイマーと脳の顕微鏡的病変には関係がある(202) ・アルツハイマーとプラークの関係を一義的にむすびつける「愚挙」221 ・へラップは、研究上の失敗と喝破(223) |
| IV. では、ここからどうする? |
・老化への考察を通して、破綻したアルツハイマー病の謎を解き明かす |
| 10. 老化の生物学から始めよう |
・老化の生物学 ・年をとることの意味は、要は老化を食い止めるメカニズムが単純にないから(230-231) ・アルツハイマーと老化関連疾患は関係している ・老化をすすめる力についての理解(例えば酸化)などが重要 235 ・修復ができなくなること(241) ・アミロイドβ中心主義的な仮説からの離脱——APPではなく、老化に焦点化されたアルツハイマー研究(247) |
| 11. アルツハイマー病の新しいモデルをつくる |
・アルツハイマーは臨床疾患である(249) ・プラークの有無を診断の基準にしてはならない(252) ・アルツハイマーは複雑である ・5種類の脳内細胞とその相互関係:ニューロン、血管、ミクログリア、アストロサイト、オリゴデンドロサイト(p.255)の図を参照 |
| 12. 研究戦略の多様化を図る |
・5種類の脳内細胞とその相互関係からなる「地区」を「都市」から「国」に拡大していく、国々のレベルでの不調がアルツハイマーになる(273ページの図) ・地区におけるミエリンが生成されない場合の障害(279) ・地区におけるアミロイドβの過剰生成(285) ・地区、都市、国の問題の系列 |
| 13. 関連機関のあり方を見直す |
・アミロイドマフィアのことを秘密結社(cabal)と著者は呼ぶ(297)——原著 p.228 ・アルツハイマー研究に関する国の予算を見直す(299) ・製薬産業の役割をみなおす(304) ・アドバイザーの役割を見直す(310) ・専門家協会をみなおす(321) ・専門家向けおよび一般向けのメディアの役割をみなおす(313) |
| 14. 終わりに |
・全体のサマリーになっている |
| 謝辞 |
|
| 原注 |
|
| 索引 |
A~ peptide, 61, 65, 74, 80, 216,
219
Adacanumab, 128,129
Aging, 169, 185
evolution, 173-175
metabolism,, 177-178
oxidation, 176, 181
research, 207-210
senescence, 183-184
Alpha secretase, 63-65
Alzheimer's Association, 113, 154,
164-166, 239-240
Amyloid, 25-28, 50, 55-56, 189-190,
216,218
Amyloid burden, 162
Amyloid cascade hypothesis, 73-96,
131-148, 187,199,205,211,215,
221,228
Amyloid precursor protein, 61-65,
74-83, 138,216,218
Anosognosia, 10
Antagonistic pleiotrophy, 17 4-17 5
APOE,5,37,44-45,85-87, 190
Alzheimer's disease Astrocytes, 192-204, 218
2011 guidelines, 158-165, 188, 228 Autism spectrum, 224
2018 guidelines, 164-166, 188,216,228
familial, 34-35
mouse models, 66-69, 135-143
preclinical, 162-165, 189, 229
spectrum, 224
sporadic, 35
vaccine, 68-70, 139-145
Alzheimer's disease, definition, 3, 8,
148-149, 188-189,224-225,228-229
CERAO, 156, 188
gold standard, 158-60, 228-229
inflation, 10, 107, 150, 187-188
Bartzokis, George, 87-91
Bayer, Friedrich, 117
Beta secretase, 62-65, 90, 145-146
Beyruther, Konrad, 60
Biogen, 128-130
Biomarkers, 160, 220, 224
Blood pressure, 20-21, 200, 222
Blood vessel cells, 45, 55-56, 76,
192-204
Braak, Heiko, 153, 163
Butler, Robert, 105 ++++++++++++++ Calcium, 47-49, 75-76, 80, 82 Central Dogma of Alzheimer's disease, 71-72 Central Dogma of molecular biology, 56-59, 63,179 Central Dogma of the pharmaceutical industry, 118 Cholesterol, 85-87, 220 Cholinergic hypothesis, 50-51 Clinical trials, 119, 126, 187, 235 prevention, 42 therapeutic, 42-43 Dementia, 10, 110, 189, 213, 221, 224 frontotemporal, 224 Lewy body, 190, 224 progressive supranuclear palsy, 190 vascular, 10, 190, 199-200, 223 Diabetes, 19-20, 184, 188, 220, 221-222 Disease gene, 3 7 DNA damage, 179-180, 208-210 Down syndrome, 55-56, 59-60, 77, 82 Drug development, 119-130, 215, 235 Education, 18-19 Executive function, 20, 189 FINGER, 20 Gamma secretase, 62-65, 90, 145-146 Garrett, Mario, 166, 188 Glenner, George, 54-56, 59 Hardy, John, 73-79, 92 Hayflick, Leonard, 183 Higgins, Gerald, 73-78, 92 Hippocampus, 199 Infection, 49-50 Inflammation, 17-18, 40, 84, 180-181, 193,213,218 Insulin, 19-20, 38-39, 57, 61, 177-178, 184,210,221-222,240-241 Journals, 240-241 Katzman, Robert, 105, 150, 157, 188 Khachaturian, Zaven, 105, 155, 157 Kinyoun, Joseph, 103 Kraepelin, Emil, 25-27, 31, 51, 63-65, 73, 76-77, 106,149,188 Lipids, 43-45, 85-87, 90 Lysosomes, 46, 75-76, 80, 82, 91-92 Medicare, 14 Mediterranean diet, 19, 39 Microbiome, 222 Microglia, 41, 192-204, 213-214, 217 Mild cognitive impairment, 133, 161 Mitochondria, 46-47, 92, 112, 164, 178-179, 198,230,240 Muller-Hill, Benno, 60 Multiple sclerosis, 104, 214 Myelin, 45, 48-49, 87-91, 204-205, 211-215, 219 National Institute on Aging (NIA), 149, 154,158, 164-166 funding, 229-233 history, 105-114 research, 107-114 National Institute of Neurological Diseases and Stroke (NINDS), 104-105 108, 112, 230 National Institutes of Health, 101-113, 121,149,215,227 research funding, 99-114, 121 Neighborhood model, 192-204, 209 aging, 198-204 burn-in, 199-204, 209, 220-223 pixel, 196, 198, 204 Nerve cell death, 76 NSAIDs, 17-18,40-43,222 Nun's study, 18 ++++++++++++++ Oligodendrocytes, 192-205, 212-215, 218 Oxidation, 80, 92-94, 176 Parkinson's disease, 10, 94, 104-105, 112, 153, 156, 199 Perry, George, 93 Pharmaceutical industry (PhRMA), 115-130, 166, 215 government partnership, 227-239 history, 117-118 research, 121-130, 234-237 university partnership, 233-236 Pittsburgh compound B, 133, 140 Plaques, 25-28,50-54, 62-65, 68-69, 84, 107, 113, 151-158, 189, 220 Preclinical Alzheimer's, 229 Presenile dementia, 11, 31-32, 107, 149-150, 154-155 Presenilin, 64-65, 81, 90-91, 136, 138 Press, 241 Risk factor gene, 37 Roche Institute of Molecular Biology, 123 Schenk, Dale, 68-69 Selkoe, Dennis, 79, 92 Senile dementia, 10, 150-154 Smith, Mark, 93 SNP (single nucleotide polymorphism), 35,38 Statins, 18, 86-87, 110 Synapse, 50-51, 86,138,172,191 Tangles, 75, 95, 107, 220 Tau, 75-76,80, 84, 90-91,95, 113-114, 160-161, 169,220, 232-233, 241 Tomlinson, Bernard Evans, Gary Blessed, and Martin Roth, 150-154 257 University research, 234, 236 Vesicles, 44, 46-47, 76, 90-92 Wong, Caine, 54-56, 59 |
| Alzheimer's
disease (AD) is a neurodegenerative disease that usually
starts slowly
and progressively worsens,[2] and is the cause of 60–70% of cases of
dementia.[2][15] The most common early symptom is difficulty in
remembering recent events.[1] As the disease advances, symptoms can
include problems with language, disorientation (including easily
getting lost), mood swings, loss of motivation, self-neglect, and
behavioral issues.[2] As a person's condition declines, they often
withdraw from family and society.[16] Gradually, bodily functions are
lost, ultimately leading to death. Although the speed of progression
can vary, the average life expectancy following diagnosis is three to
twelve years.[11][12][13] The cause of Alzheimer's disease is poorly understood.[16] There are many environmental and genetic risk factors associated with its development. The strongest genetic risk factor is from an allele of apolipoprotein E.[17][18] Other risk factors include a history of head injury, clinical depression, and high blood pressure.[1] The progress of the protein misfolding disease is largely associated with amyloid plaques, neurofibrillary tangles, and loss of neuronal connections in the brain.[19] A probable diagnosis is based on the history of the illness and cognitive testing, with medical imaging and blood tests to rule out other possible causes.[8][20] Initial symptoms are often mistaken for normal brain aging.[16] Examination of brain tissue is needed for a definite diagnosis, but this can only take place after death.[21][22] No treatments can stop or reverse its progression, though some may temporarily improve symptoms.[2] A healthy diet, physical activity, and social engagement are generally beneficial in ageing, and may help in reducing the risk of cognitive decline and Alzheimer's.[19] Affected people become increasingly reliant on others for assistance, often placing a burden on caregivers.[23] The pressures can include social, psychological, physical, and economic elements.[23] Exercise programs may be beneficial with respect to activities of daily living and can potentially improve outcomes.[24] Behavioral problems or psychosis due to dementia are sometimes treated with antipsychotics, but this has an increased risk of early death.[25][26] As of 2020, there were approximately 50 million people worldwide with Alzheimer's disease.[14] It most often begins in people over 65 years of age, although up to 10% of cases are early-onset impacting those in their 30s to mid-60s.[27][4] It affects about 6% of people 65 years and older,[16] and women more often than men.[28] The disease is named after German psychiatrist and pathologist Alois Alzheimer, who first described it in 1906.[29] Alzheimer's financial burden on society is large, with an estimated global annual cost of US$1 trillion.[14] It is ranked as the seventh leading cause of death worldwide.[30] |
ア
ルツハイマー病(AD)は神経変性疾患であり、通常はゆっくりと始まり徐々に悪化する[2]。
[1]病状が進行すると、言語障害、見当識障害(道に迷いやすいなど)、気分の落ち込み、意欲の喪失、セルフネグレクト、行動上の問題などの症状が現れる
[2]。病状が悪化すると、家族や社会から引きこもることが多くなる[16]。
徐々に身体機能が失われ、最終的には死に至る。進行の速度は様々であるが、診断後の平均余命は3~12年である[11][12][13]。 アルツハイマー病の原因はよくわかっていない。最も強い遺伝的危険因子は、アポリポ蛋白Eの対立遺伝子によるものである[17][18]。その他の危険因 子には、頭部外傷の既往歴、臨床的うつ病、高血圧が含まれる[1]。タンパク質のミスフォールディング病の進行は、脳内のアミロイド斑、神経原線維のもつ れ、神経細胞の結合の消失と大きく関連している。 [19] 可能性の高い診断は、病歴と認知機能検査に基づいており、他の可能性のある原因を除外するために、医学的画像診断と血液検査が行われる[8][20]。 健康的な食事、身体活動、社会的関与は、一般的に加齢に有益であり、認知機能の低下やアルツハイマー病のリスクを軽減するのに役立つ可能性がある [19]。 [運動プログラムは日常生活動作に関して有益であり、転帰を改善する可能性がある[24]。認知症による行動上の問題や精神病は抗精神病薬で治療されるこ とがあるが、これは早期死亡のリスクを増大させる[25][26]。 2020年現在、アルツハイマー病患者は世界に約5,000万人いる[14]。65歳以上で発症することが最も多いが、最大10%は30代から60代半ば の早期発症である[27][4]。 [28] この病名は、1906年に初めてこの病気について記述したドイツの精神科医で病理学者のアロイス・アルツハイマーにちなんで名付けられた[29] 。 社会におけるアルツハイマーの経済的負担は大きく、世界全体で年間1兆米ドルと推定されている[14] 。 |
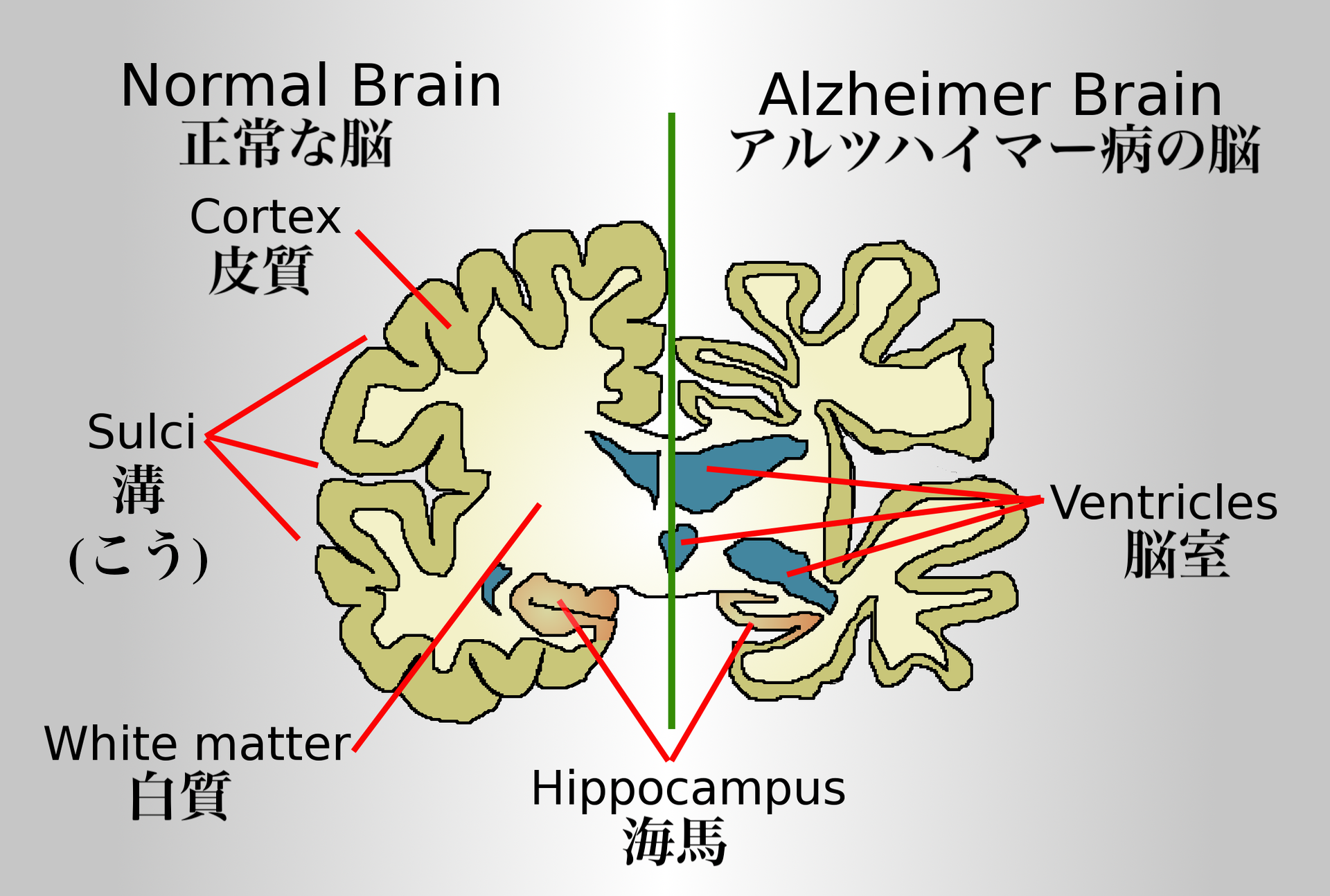
| Signs and symptoms The course of Alzheimer's is generally described in three stages, with a progressive pattern of cognitive and functional impairment.[31][27] The three stages are described as early or mild, middle or moderate, and late or severe.[31] The disease is known to target the hippocampus which is associated with memory, and this is responsible for the first symptoms of memory impairment. As the disease progresses so does the degree of memory impairment.[19] First symptoms 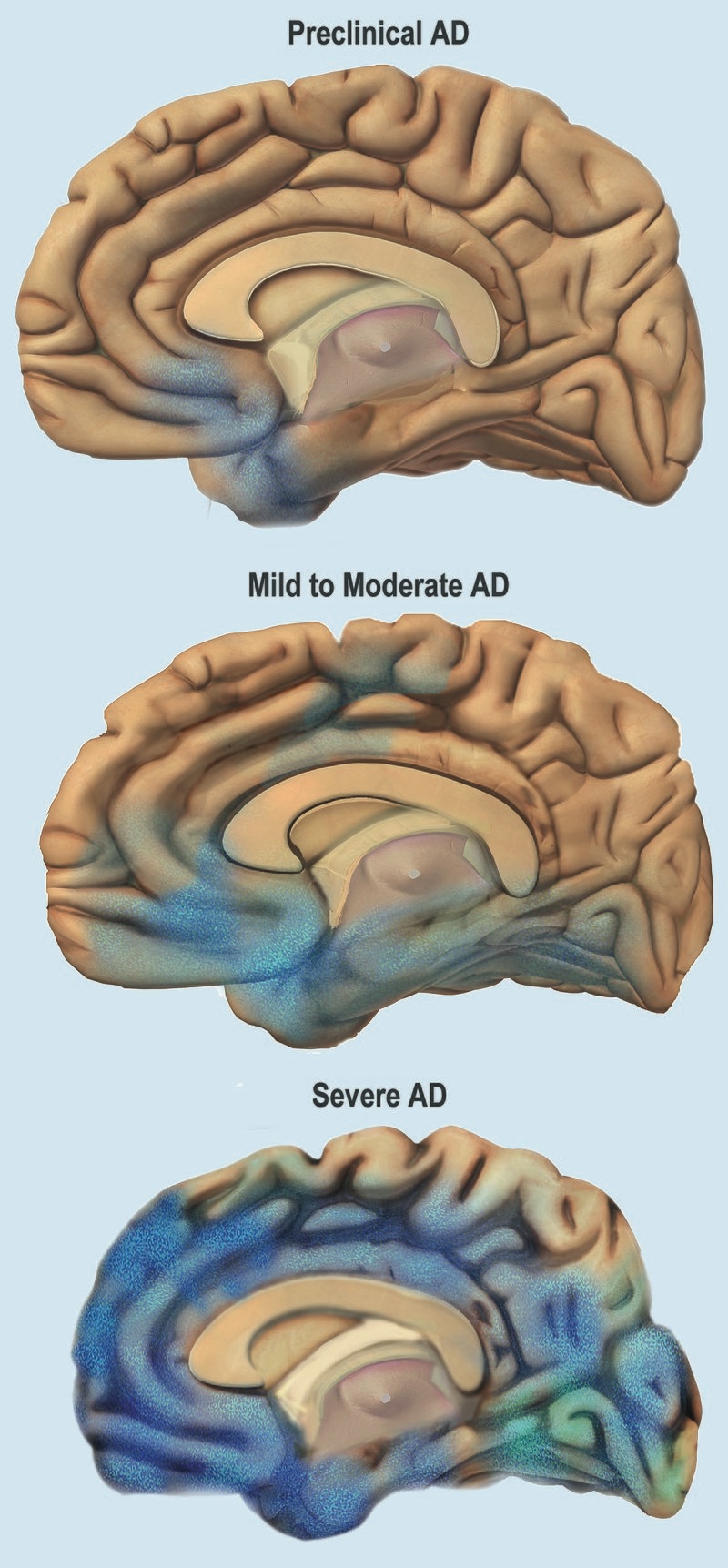 Stages of atrophy in Alzheimer's The first symptoms are often mistakenly attributed to ageing or stress.[32] Detailed neuropsychological testing can reveal mild cognitive difficulties up to eight years before a person fulfills the clinical criteria for diagnosis of Alzheimer's disease.[33] These early symptoms can affect the most complex activities of daily living.[34] The most noticeable deficit is short term memory loss, which shows up as difficulty in remembering recently learned facts and inability to acquire new information.[33] Subtle problems with the executive functions of attentiveness, planning, flexibility, and abstract thinking, or impairments in semantic memory (memory of meanings, and concept relationships) can also be symptomatic of the early stages of Alzheimer's disease.[33] Apathy and depression can be seen at this stage, with apathy remaining as the most persistent symptom throughout the course of the disease.[35][36] Mild cognitive impairment (MCI) is often found to be a transitional stage between normal aging and dementia. MCI can present with a variety of symptoms, and when memory loss is the predominant symptom, it is termed amnestic MCI and is frequently seen as a prodromal stage of Alzheimer's disease.[37] Amnesic MCI has a greater than 90% likelihood of being associated with Alzheimer's.[38] Early stage In people with Alzheimer's disease, the increasing impairment of learning and memory eventually leads to a definitive diagnosis. In a small percentage, difficulties with language, executive functions, perception (agnosia), or execution of movements (apraxia) are more prominent than memory problems.[39] Alzheimer's disease does not affect all memory capacities equally. Older memories of the person's life (episodic memory), facts learned (semantic memory), and implicit memory (the memory of the body on how to do things, such as using a fork to eat or how to drink from a glass) are affected to a lesser degree than new facts or memories.[40][41] Language problems are mainly characterised by a shrinking vocabulary and decreased word fluency, leading to a general impoverishment of oral and written language.[39][42] In this stage, the person with Alzheimer's is usually capable of communicating basic ideas adequately.[39][42][43] While performing fine motor tasks such as writing, drawing, or dressing, certain movement coordination and planning difficulties (apraxia) may be present, but they are commonly unnoticed.[39] As the disease progresses, people with Alzheimer's disease can often continue to perform many tasks independently, but may need assistance or supervision with the most cognitively demanding activities.[39] Middle stage Progressive deterioration eventually hinders independence, with subjects being unable to perform most common activities of daily living.[39] Speech difficulties become evident due to an inability to recall vocabulary, which leads to frequent incorrect word substitutions (paraphasias). Reading and writing skills are also progressively lost.[39][43] Complex motor sequences become less coordinated as time passes and Alzheimer's disease progresses, so the risk of falling increases.[39] During this phase, memory problems worsen, and the person may fail to recognise close relatives.[39] Long-term memory, which was previously intact, becomes impaired.[39] Behavioral and neuropsychiatric changes become more prevalent. Common manifestations are wandering, irritability and emotional lability, leading to crying, outbursts of unpremeditated aggression, or resistance to caregiving.[39] Sundowning can also appear.[44] Approximately 30% of people with Alzheimer's disease develop illusionary misidentifications and other delusional symptoms.[39] Subjects also lose insight of their disease process and limitations (anosognosia).[39] Urinary incontinence can develop.[39] These symptoms create stress for relatives and caregivers, which can be reduced by moving the person from home care to other long-term care facilities.[39][45] Late stage 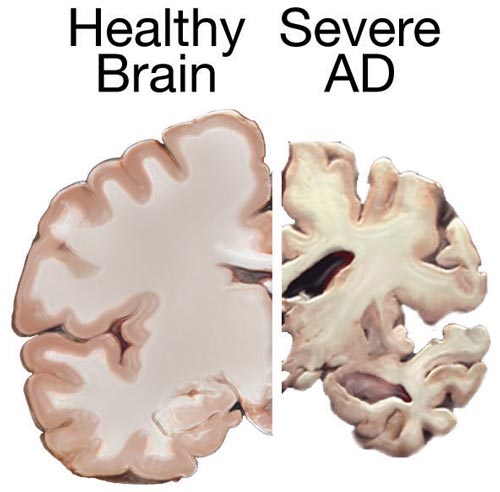 A normal brain on the left and a late-stage Alzheimer's brain on the right During the final stage, known as the late-stage or severe stage, there is complete dependence on caregivers.[19][31][39] Language is reduced to simple phrases or even single words, eventually leading to complete loss of speech.[39][43] Despite the loss of verbal language abilities, people can often understand and return emotional signals. Although aggressiveness can still be present, extreme apathy and exhaustion are much more common symptoms. People with Alzheimer's disease will ultimately not be able to perform even the simplest tasks independently; muscle mass and mobility deteriorates to the point where they are bedridden and unable to feed themselves. The cause of death is usually an external factor, such as infection of pressure ulcers or pneumonia, not the disease itself.[39] In some cases, there is a paradoxical lucidity immediately before death, where there is an unexpected re |
徴候と症状 アルツハイマー病の経過は、一般に3つの病期に分けられ、認知機能障害と機能障害が進行する[31][27]。3つの病期は、初期または軽度、中期または 中等度、後期または重度と表現される[31]。病気が進行するにつれて、記憶障害の程度も増加する[19]。 最初の症状  アルツハイマー病における萎縮の段階 初発症状は、しばしば加齢やストレスに起因すると誤解される[32]。詳細な神経心理学的検査により、アルツハイマー病の臨床診断基準を満たす8年前まで に軽度の認知障害が明らかになることがある[33]。これらの初期症状は、最も複雑な日常生活動作に影響を及ぼす可能性がある[34]。最も顕著な障害は 短期記憶障害であり、最近学習した事実を思い出すことの困難さや新しい情報を習得することの不能さとして現れる[33]。 注意力、計画性、柔軟性、抽象的思考などの実行機能の微妙な問題や、意味記憶(意味や概念の関係の記憶)の障害も、アルツハイマー病の初期段階の症状であ る可能性がある[33]。 この段階では無気力や抑うつがみられることがあり、無気力は病気の経過を通じて最も持続的な症状として残る[35][36]。軽度認知障害(MCI)は、 正常な老化と認知症の間の過渡期であることがしばしば認められる。MCIは様々な症状を呈するが、記憶喪失が優勢な症状である場合は健忘性MCIと呼ば れ、アルツハイマー病の前駆期としてしばしばみられる[37]。健忘性MCIは、アルツハイマー病と関連する可能性が90%を超える[38]。 初期段階 アルツハイマー病患者では、学習および記憶の障害の増大により、最終的に確定診断に至る。ごく一部の患者では、言語、実行機能、知覚(失認)、または動作 の実行(失行)の障害が、記憶の問題よりも顕著である[39]。その人の人生に関する古い記憶(エピソード記憶)、学習した事実(意味記憶)、および暗黙 的記憶(フォークを使った食事やコップからの飲み方など、物事をどのように行うかに関する身体の記憶)は、新しい事実や記憶よりも低い程度で影響を受ける [40][41]。 この段階では、アルツハイマー病患者は通常、基本的な考えを十分に伝えることができる。 [39][42][43]筆記、描画、または着替えなどの細かい運動作業を行っている間、特定の運動協調および計画困難(失行)が存在する可能性がある が、一般的に気付かれない[39]。 病気が進行すると、アルツハイマー病患者は多くの作業を独立して継続することができるが、最も認知的に負荷の高い活動については、介助または監督が必要に なることがある[39]。 中期 進行性の悪化は最終的に自立を妨げ、対象者は日常生活のほとんどの一般的な活動を行うことができなくなる[39]。語彙を想起することができなくなり、 誤った言葉の置き換え(paraphasias)が頻繁に起こるようになるため、発話障害が明らかになる。また、読み書きの能力も徐々に失われていく [39][43]。時間が経過しアルツハイマー病が進行すると、複雑な運動シーケンスの協調性が低下するため、転倒の危険性が増大する[39]。この段階 では、記憶障害が悪化し、近親者を認識できなくなることがある[39]。以前は無傷であった長期記憶が障害されるようになる[39]。 行動および精神神経系の変化がより顕著になる。一般的な症状として、徘徊、易刺激性、情緒不安定があり、泣き出したり、突発的な攻撃性を示したり、介護に 抵抗したりする[39]。 [これらの症状は親族や介護者にストレスを与えるが、在宅介護から他の介護施設に移ることで軽減できる[39][45]。 後期  左が正常な脳、右が後期アルツハイマー型認知症の脳 後期または重度段階として知られる最終段階では、介護者に完全に依存するようになる[19][31][39]。 言語は単純なフレーズや単語にまで減少し、最終的には完全に発語しなくなる[39][43]。言語能力の喪失にもかかわらず、人々はしばしば感情的なシグ ナルを理解し、返すことができる。攻撃性は依然として存在しうるが、極度の無気力と疲労がより一般的な症状である。アルツハイマー病の患者は、最終的に最 も単純な作業さえも独立して行うことができなくなり、筋肉量と運動能力は、寝たきりになり、自分で食事をとることができなくなるほど悪化する。死因は通 常、病気そのものではなく、褥瘡や肺炎の感染などの外的要因である。 |
| Causes Alzheimer's disease is believed to occur when abnormal amounts of amyloid beta (Aβ), accumulating extracellularly as amyloid plaques and tau proteins, or intracellularly as neurofibrillary tangles, form in the brain, affecting neuronal functioning and connectivity, resulting in a progressive loss of brain function.[47][48] This altered protein clearance ability is age-related, regulated by brain cholesterol,[49] and associated with other neurodegenerative diseases.[50][51] The cause for most Alzheimer's cases is still mostly unknown,[14] except for 1–2% of cases where deterministic genetic differences have been identified.[17] Several competing hypotheses attempt to explain the underlying cause; the most predominant hypothesis is the amyloid beta (Aβ) hypothesis.[14] The oldest hypothesis, on which most drug therapies are based, is the cholinergic hypothesis, which proposes that Alzheimer's disease is caused by reduced synthesis of the neurotransmitter acetylcholine.[14] The loss of cholinergic neurons noted in the limbic system and cerebral cortex, is a key feature in the progression of Alzheimer's.[37] The 1991 amyloid hypothesis postulated that extracellular amyloid beta (Aβ) deposits are the fundamental cause of the disease.[52][53] Support for this postulate comes from the location of the gene for the amyloid precursor protein (APP) on chromosome 21, together with the fact that people with trisomy 21 (Down syndrome) who have an extra gene copy almost universally exhibit at least the earliest symptoms of Alzheimer's disease by 40 years of age.[10] A specific isoform of apolipoprotein, APOE4, is a major genetic risk factor for Alzheimer's disease.[15] While apolipoproteins enhance the breakdown of beta amyloid, some isoforms are not very effective at this task (such as APOE4), leading to excess amyloid buildup in the brain.[54] Genetic Late onset Late-onset Alzheimer's is about 70% heritable.[55][56] Genetic models in 2020 predict Alzheimer's disease with 90% accuracy.[57] Most cases of Alzheimer's are not familial, and so they are termed sporadic Alzheimer's disease.[medical citation needed] Most cases of sporadic Alzheimer's disease are late onset, developing after the age of 65 years.[58] The strongest genetic risk factor for sporadic Alzheimer's disease is APOEε4.[18] APOEε4 is one of four alleles of apolipoprotein E (APOE). APOE plays a major role in lipid-binding proteins in lipoprotein particles and the ε4 allele disrupts this function.[59] Between 40 and 80% of people with Alzheimer's disease possess at least one APOEε4 allele.[60] The APOEε4 allele increases the risk of the disease by three times in heterozygotes and by 15 times in homozygotes.[61] Like many human diseases, environmental effects and genetic modifiers result in incomplete penetrance. For example, Nigerian Yoruba people do not show the relationship between dose of APOEε4 and incidence or age-of-onset for Alzheimer's disease seen in other human populations.[62][63] Early onset Further information: Early-onset Alzheimer's disease Only 1–2% of Alzheimer's cases are inherited due to autosomal dominant effects, as Alzheimer's is highly polygenic. When the disease is caused by autosomal dominant variants, it is known as early onset familial Alzheimer's disease, which is rarer and has a faster rate of progression.[17] Less than 5% of sporadic Alzheimer's disease have an earlier onset,[17] and early-onset Alzheimer's is about 90% heritable.[55][56] FAD usually implies multiple persons affected in one or more generations.[medical citation needed][64] Early onset familial Alzheimer's disease can be attributed to mutations in one of three genes: those encoding amyloid-beta precursor protein (APP) and presenilins PSEN1 and PSEN2.[38] Most mutations in the APP and presenilin genes increase the production of a small protein called amyloid beta (Aβ)42, which is the main component of amyloid plaques.[65] Some of the mutations merely alter the ratio between Aβ42 and the other major forms—particularly Aβ40—without increasing Aβ42 levels in the brain.[66] Two other genes associated with autosomal dominant Alzheimer's disease are ABCA7 and SORL1.[67] Alleles in the TREM2 gene have been associated with a three to five times higher risk of developing Alzheimer's disease.[68] A Japanese pedigree of familial Alzheimer's disease was found to be associated with a deletion mutation of codon 693 of APP.[69] This mutation and its association with Alzheimer's disease was first reported in 2008,[70] and is known as the Osaka mutation. Only homozygotes with this mutation have an increased risk of developing Alzheimer's disease. This mutation accelerates Aβ oligomerization but the proteins do not form the amyloid fibrils that aggregate into amyloid plaques, suggesting that it is the Aβ oligomerization rather than the fibrils that may be the cause of this disease. Mice expressing this mutation have all the usual pathologies of Alzheimer's disease.[71] Hypotheses Amyloid-beta and tau protein 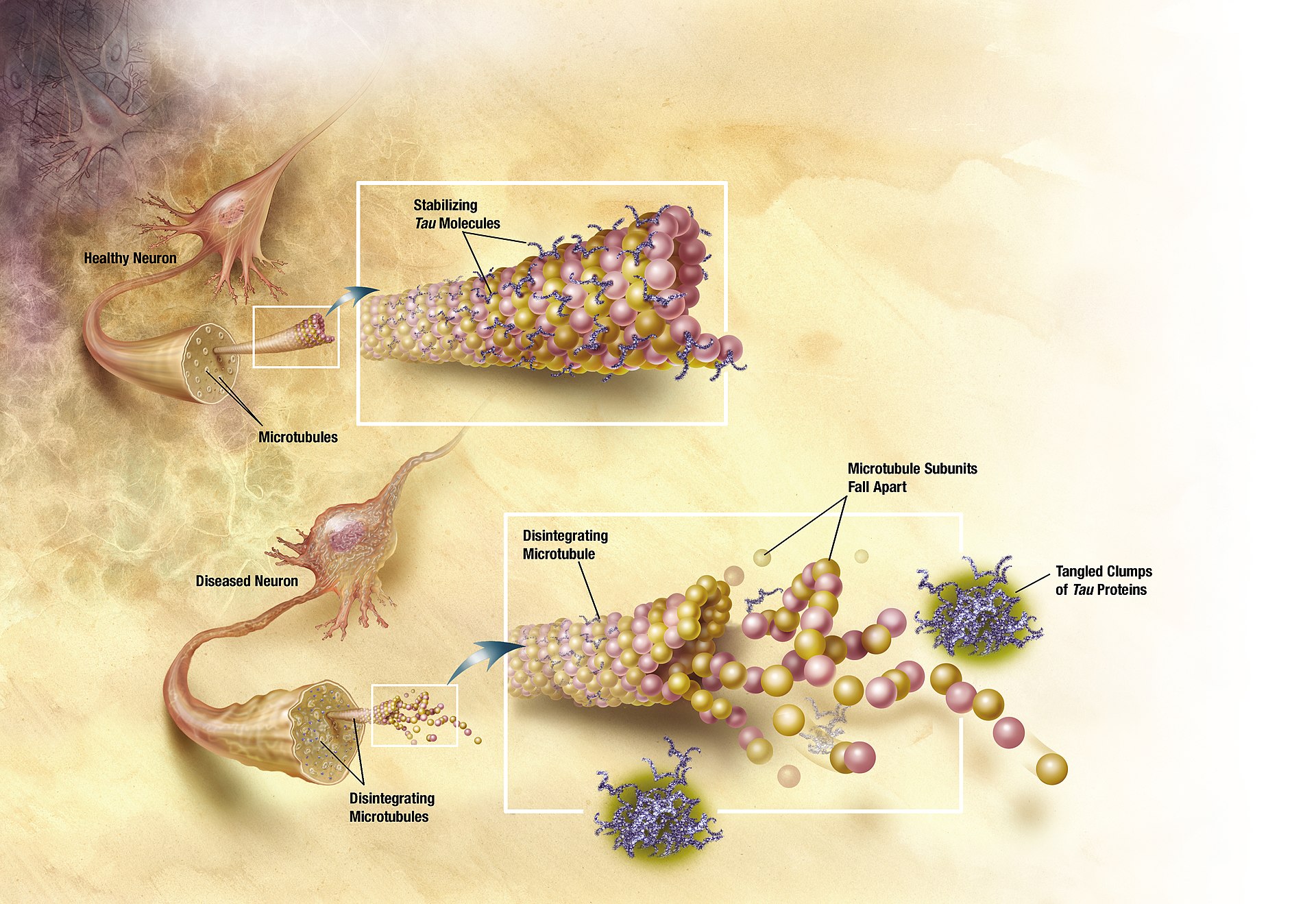 In Alzheimer's disease, changes in tau protein lead to the disintegration of microtubules in brain cells. The tau hypothesis proposes that tau protein abnormalities initiate the disease cascade.[53] In this model, hyperphosphorylated tau begins to pair with other threads of tau as paired helical filaments. Eventually, they form neurofibrillary tangles inside nerve cell bodies.[72] When this occurs, the microtubules disintegrate, destroying the structure of the cell's cytoskeleton which collapses the neuron's transport system.[73] A number of studies connect the misfolded amyloid beta and tau proteins associated with the pathology of Alzheimer's disease, as bringing about oxidative stress that leads to neuroinflammation.[74] This chronic inflammation is also a feature of other neurodegenerative diseases including Parkinson's disease, and ALS.[75] Spirochete infections have also been linked to dementia.[14] DNA damages accumulate in AD brains; reactive oxygen species may be the major source of this DNA damage.[76] Sleep Sleep disturbances are seen as a possible risk factor for inflammation in Alzheimer's disease.[77] Sleep disruption was previously only seen as a consequence of Alzheimer's disease, but as of 2020, accumulating evidence suggests that this relationship may be bidirectional.[78] Metal toxicity, smoking, neuroinflammation and air pollution The cellular homeostasis of biometals such as ionic copper, iron, and zinc is disrupted in Alzheimer's disease, though it remains unclear whether this is produced by or causes the changes in proteins.[14][79] Smoking is a significant Alzheimer's disease risk factor.[1] Systemic markers of the innate immune system are risk factors for late-onset Alzheimer's disease.[80] Exposure to air pollution may be a contributing factor to the development of Alzheimer's disease.[14] Other hypotheses See also: Cell cycle hypothesis of Alzheimer's disease and Ion channel hypothesis of Alzheimer's disease Retrogenesis is a medical hypothesis that just as the fetus goes through a process of neurodevelopment beginning with neurulation and ending with myelination, the brains of people with Alzheimer's disease go through a reverse neurodegeneration process starting with demyelination and death of axons (white matter) and ending with the death of grey matter.[81] Likewise the hypothesis is, that as infants go through states of cognitive development, people with Alzheimer's disease go through the reverse process of progressive cognitive impairment.[82] The association with celiac disease is unclear, with a 2019 study finding no increase in dementia overall in those with CD, while a 2018 review found an association with several types of dementia including Alzheimer's disease.[83][84] According to one theory, dysfunction of oligodendrocytes and their associated myelin during aging contributes to axon damage, which in turn generates in amyloid production and tau hyper-phosphorylation.[85][86] Studies have shown a potential link between infection with certain viruses and developing Alzheimer's disease later in life.[87] Notably, a large scale study conducted on 6,245,282 patients has shown an increased risk of developing Alzheimer's disease following COVID-19 infection in cognitively normal individuals over 65.[88] |
原因 アルツハイマー病は、異常な量のアミロイドβ(Aβ)が、細胞外ではアミロイド斑やタウ蛋白として、細胞内では神経原線維のもつれとして蓄積し、脳内に形 成されることで発症すると考えられており、神経細胞の機能や結合性に影響を及ぼし、その結果、脳機能の低下が進行する[47][48]。この蛋白クリアラ ンス能力の変化は、加齢に関連し、脳内コレステロールによって制御され[49]、他の神経変性疾患と関連している[50][51]。 決定論的な遺伝的差異が同定された1~2%の症例を除き、ほとんどのアルツハイマー病の症例の原因はまだほとんど不明である[14]。いくつかの競合する 仮説が根本的な原因の説明を試みているが、最も優勢な仮説はアミロイドβ(Aβ)仮説である[14]。 最も古い仮説はコリン作動性仮説であり、ほとんどの薬物療法はこの仮説に基づいている。コリン作動性仮説では、アルツハイマー病は神経伝達物質であるアセ チルコリンの合成の減少によって引き起こされると提唱している。 [大脳辺縁系および大脳皮質で認められるコリン作動性ニューロンの喪失は、アルツハイマー病の進行における重要な特徴である[37]。1991年のアミロ イド仮説は、細胞外アミロイドβ(Aβ)沈着が疾患の根本的な原因であると仮定した。 [この仮説の支持は、21番染色体上のアミロイド前駆体タンパク質(APP)の遺伝子の位置と、余分な遺伝子コピーを持つトリソミー21(ダウン症候群) の人々がほぼ例外なく40歳までに少なくともアルツハイマー病の初期症状を示すという事実から得られている。 [10] アポリポ蛋白の特定のアイソフォームであるAPOE4は、アルツハイマー病の主要な遺伝的危険因子である[15]。アポリポ蛋白はβアミロイドの分解を促 進するが、アイソフォームによっては(APOE4のように)この作業があまり効果的でないものもあり、脳内にアミロイドが過剰に蓄積することになる [54]。 遺伝的 遅発性 遅発性アルツハイマー病は約70%が遺伝性である[55][56]。2020年の遺伝モデルは90%の精度でアルツハイマー病を予測する[57]。アルツ ハイマー病のほとんどの症例は家族性ではないため、散発性アルツハイマー病と呼ばれる。 散発性アルツハイマー病の最も強い遺伝的危険因子はAPOEε4である[18]。APOEε4は、リポ蛋白粒子における脂質結合蛋白の主要な役割を担って おり、ε4対立遺伝子はこの機能を破壊する。アルツハイマー病患者の40~80%は、少なくとも1つのAPOEε4対立遺伝子を持っている[60]。 APOEε4対立遺伝子は、ヘテロ接合体では3倍、ホモ接合体では15倍アルツハイマー病のリスクを増加させる[61]。例えば、ナイジェリアのヨルバ人 は、APOEε4の用量と他のヒト集団でみられるアルツハイマー病の発症率や発症年齢との関係を示さない[62][63]。 早期発症 さらに詳しい情報 早期発症アルツハイマー病 アルツハイマー病は高度に多遺伝子性であるため、常染色体優性遺伝によるアルツハイマー病症例の1~2%のみが遺伝する。常染色体優性遺伝の場合、早期発 症型家族性アルツハイマー病として知られ、よりまれであり、進行速度が速い。散発性アルツハイマー病の5%未満が早期発症型であり[17]、早期発症型ア ルツハイマー病は約90%が遺伝性である[55][56]。 早期発症の家族性アルツハイマー病は、アミロイドβ前駆体タンパク質(APP)およびプレセニリンPSEN1およびPSEN2をコードする3つの遺伝子の いずれかの変異に起因する可能性がある[38]。APPおよびプレセニリン遺伝子の変異のほとんどは、アミロイド斑の主成分であるアミロイドβ(Aβ) 42と呼ばれる小さなタンパク質の産生を増加させる。 [65] 変異の中には、脳内のAβ42レベルを増加させることなく、Aβ42と他の主要な形態-特にAβ40-との間の比率を変化させるだけのものもある [66]。常染色体優性アルツハイマー病に関連する他の2つの遺伝子は、ABCA7とSORL1である[67]。 TREM2遺伝子の対立遺伝子は、アルツハイマー病を発症するリスクが3~5倍高いことと関連している[68]。 家族性アルツハイマー病の日本人血統は、APPのコドン693の欠失変異と関連していることが発見された[69]。この変異とアルツハイマー病との関連は 2008年に初めて報告され[70]、大阪変異として知られている。この変異を持つホモ接合体のみがアルツハイマー病を発症するリスクが高い。この変異は Aβのオリゴマー化を促進するが、タンパク質はアミロイド斑に凝集するアミロイド線維を形成しないことから、この疾患の原因は線維よりもむしろAβのオリ ゴマー化であることが示唆される。この変異を発現しているマウスは、アルツハイマー病の通常の病態をすべて有している[71]。 仮説 アミロイドβとタウ蛋白  アルツハイマー病では、タウ蛋白の変化が脳細胞の微小管の崩壊を引き起こす。 タウ仮説は、タウ蛋白質の異常が疾患カスケードを開始させることを提唱している[53]。このモデルでは、高リン酸化タウは対になったらせん状フィラメン トとして他のタウ糸と対になり始める。これが起こると微小管が崩壊し、細胞の細胞骨格の構造が破壊され、ニューロンの輸送系が崩壊する。 この慢性炎症は、パーキンソン病やALSを含む他の神経変性疾患の特徴でもある[75]。スピロヘータ感染もまた認知症と関連している[14]。 睡眠 睡眠障害は、アルツハイマー病における炎症の危険因子と考えられている[77]。以前は、睡眠障害はアルツハイマー病の結果としてのみ捉えられていたが、 2020年現在、この関係は双方向性である可能性を示唆する証拠が蓄積されている[78]。 金属毒性、喫煙、神経炎症、大気汚染 イオン性銅、鉄、亜鉛などの生体金属の細胞恒常性はアルツハイマー病で破壊されるが、これがタンパク質によって産生されるのか、またはタンパク質の変化を 引き起こすのかは依然として不明である[14][79]。 喫煙は重大なアルツハイマー病の危険因子である[1]。 自然免疫系の全身性マーカーは遅発性アルツハイマー病の危険因子である[80]。大気汚染への暴露はアルツハイマー病の発症の一因である可能性がある [14]。 その他の仮説 以下も参照: アルツハイマー病の細胞周期仮説とアルツハイマー病のイオンチャネル仮説 レトロジェネシスとは、胎児が神経形成から始まり髄鞘形成で終わる神経発達の過程を経るように、アルツハイマー病患者の脳は、脱髄と軸索(白質)の死から 始まり灰白質の死で終わる逆の神経変性過程を経るという医学的仮説である[81]。 同様に、乳児が認知発達の状態を経るように、アルツハイマー病患者は進行性認知障害の逆の過程を経るという仮説である[82]。 セリアック病との関連は不明確であり、2019年の研究ではCD患者では認知症全体の増加は認められなかったが、2018年のレビューではアルツハイマー 病を含むいくつかのタイプの認知症との関連が認められた[83][84]。 一説によると、加齢に伴うオリゴデンドロサイトとそれに関連するミエリンの機能障害は軸索の損傷を助長し、その結果アミロイドの産生とタウの過剰リン酸化 が生じる[85][86]。 研究では、特定のウイルスへの感染とアルツハイマー病の発症との間の潜在的な関連性が示されている[87]。特に、6,245,282人の患者に対して実 施された大規模研究では、65歳以上の認知機能が正常な人において、COVID-19感染後にアルツハイマー病を発症するリスクが増加することが示されて いる[88]。 |
Pathophysiology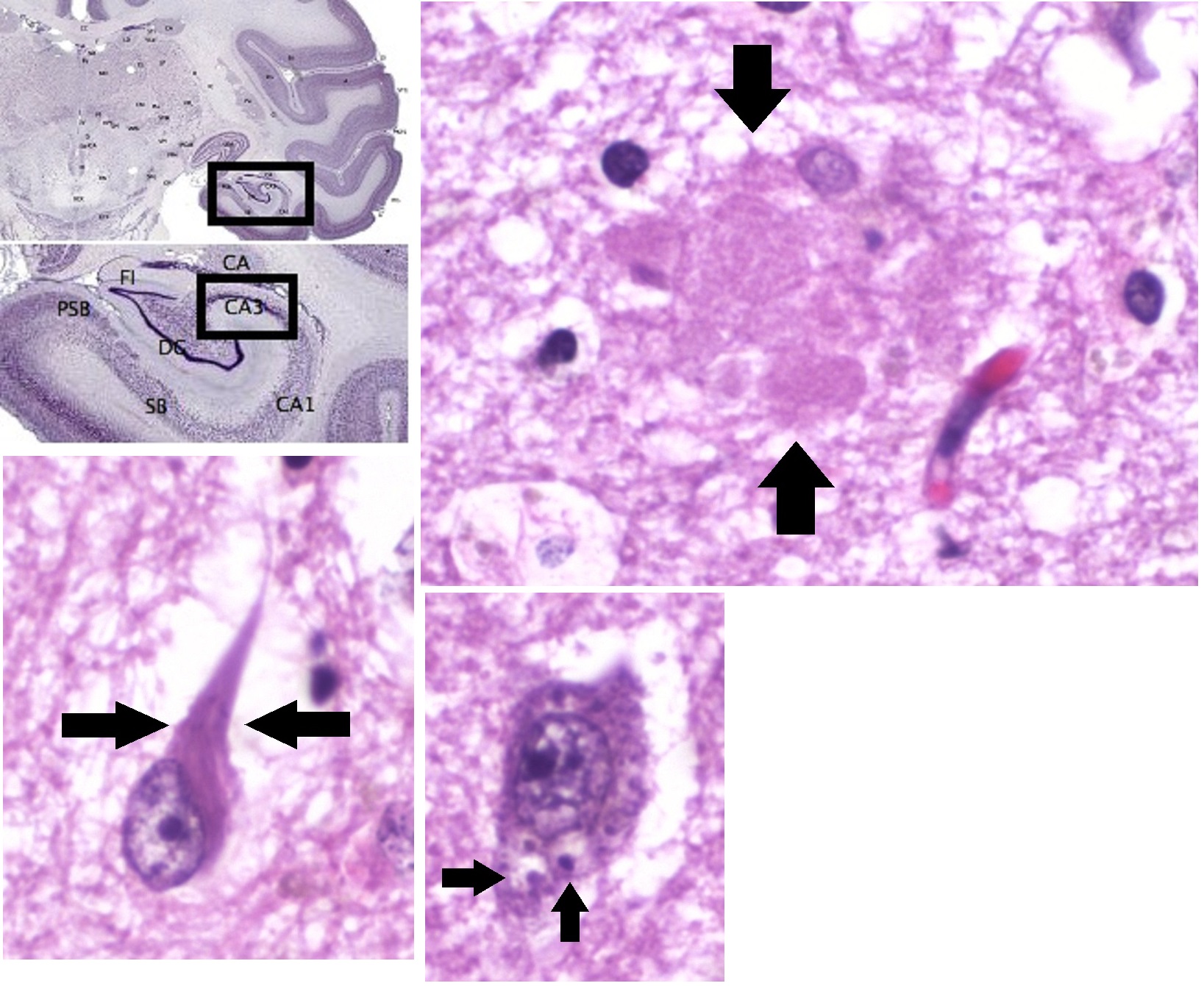 Histopathologic images of Alzheimer's disease, in the CA3 area of the hippocampus, showing an amyloid plaque (top right), neurofibrillary tangles (bottom left), and granulovacuolar degeneration bodies (bottom center) Neuropathology Alzheimer's disease is characterised by loss of neurons and synapses in the cerebral cortex and certain subcortical regions. This loss results in gross atrophy of the affected regions, including degeneration in the temporal lobe and parietal lobe, and parts of the frontal cortex and cingulate gyrus.[89] Degeneration is also present in brainstem nuclei particularly the locus coeruleus in the pons.[90] Studies using MRI and PET have documented reductions in the size of specific brain regions in people with Alzheimer's disease as they progressed from mild cognitive impairment to Alzheimer's disease, and in comparison with similar images from healthy older adults.[91][92] Both Aβ plaques and neurofibrillary tangles are clearly visible by microscopy in brains of those with Alzheimer's disease,[93] especially in the hippocampus.[94] However, Alzheimer's disease may occur without neurofibrillary tangles in the neocortex.[95] Plaques are dense, mostly insoluble deposits of beta-amyloid peptide and cellular material outside and around neurons. Tangles (neurofibrillary tangles) are aggregates of the microtubule-associated protein tau which has become hyperphosphorylated and accumulate inside the cells themselves. Although many older individuals develop some plaques and tangles as a consequence of aging, the brains of people with Alzheimer's disease have a greater number of them in specific brain regions such as the temporal lobe.[96] Lewy bodies are not rare in the brains of people with Alzheimer's disease.[97] Biochemistry Main article: Biochemistry of Alzheimer's disease 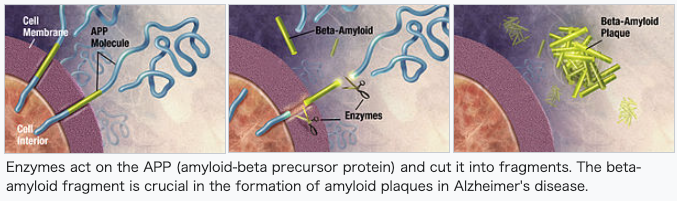 Enzymes act on the APP (amyloid-beta precursor protein) and cut it into fragments. The beta-amyloid fragment is crucial in the formation of amyloid plaques in Alzheimer's disease. Alzheimer's disease has been identified as a protein misfolding disease, a proteopathy, caused by the accumulation of abnormally folded amyloid beta protein into amyloid plaques, and tau protein into neurofibrillary tangles in the brain.[98] Plaques are made up of small peptides, 39–43 amino acids in length, called amyloid beta (Aβ). Amyloid beta is a fragment from the larger amyloid-beta precursor protein (APP) a transmembrane protein that penetrates the neuron's membrane. APP is critical to neuron growth, survival, and post-injury repair.[99][100] In Alzheimer's disease, gamma secretase and beta secretase act together in a proteolytic process which causes APP to be divided into smaller fragments.[101] One of these fragments gives rise to fibrils of amyloid beta, which then form clumps that deposit outside neurons in dense formations known as amyloid plaques.[93][102] Alzheimer's disease is also considered a tauopathy due to abnormal aggregation of the tau protein. Every neuron has a cytoskeleton, an internal support structure partly made up of structures called microtubules. These microtubules act like tracks, guiding nutrients and molecules from the body of the cell to the ends of the axon and back. A protein called tau stabilises the microtubules when phosphorylated, and is therefore called a microtubule-associated protein. In Alzheimer's disease, tau undergoes chemical changes, becoming hyperphosphorylated; it then begins to pair with other threads, creating neurofibrillary tangles and disintegrating the neuron's transport system.[103] Pathogenic tau can also cause neuronal death through transposable element dysregulation.[104] Necroptosis has also been reported as a mechanism of cell death in brain cells affected with tau tangles.[105][106] Disease mechanism Exactly how disturbances of production and aggregation of the beta-amyloid peptide give rise to the pathology of Alzheimer's disease is not known.[107][108] The amyloid hypothesis traditionally points to the accumulation of beta-amyloid peptides as the central event triggering neuron degeneration. Accumulation of aggregated amyloid fibrils, which are believed to be the toxic form of the protein responsible for disrupting the cell's calcium ion homeostasis, induces programmed cell death (apoptosis).[109] It is also known that Aβ selectively builds up in the mitochondria in the cells of Alzheimer's-affected brains, and it also inhibits certain enzyme functions and the utilisation of glucose by neurons.[110] Iron dyshomeostasis is linked to disease progression, an iron-dependent form of regulated cell death called ferroptosis could be involved. Products of lipid peroxidation are also elevated in AD brain compared with controls.[111] Various inflammatory processes and cytokines may also have a role in the pathology of Alzheimer's disease. Inflammation is a general marker of tissue damage in any disease, and may be either secondary to tissue damage in Alzheimer's disease or a marker of an immunological response.[112] There is increasing evidence of a strong interaction between the neurons and the immunological mechanisms in the brain. Obesity and systemic inflammation may interfere with immunological processes which promote disease progression.[113] Alterations in the distribution of different neurotrophic factors and in the expression of their receptors such as the brain-derived neurotrophic factor (BDNF) have been described in Alzheimer's disease.[114][115] |
病態生理 アミロイド斑(右上)、神経原線維のもつれ(左下)、顆粒球変性体(中央下)を示すアルツハイマー病の病理組織像(海馬CA3領域)。 神経病理学 アルツハイマー病は、大脳皮質と特定の皮質下領域における神経細胞とシナプスの喪失によって特徴づけられる。この損失は、側頭葉および頭頂葉、前頭皮質お よび帯状回の一部における変性を含む、罹患領域の肉眼的萎縮をもたらす。 [90]。MRIおよびPETを用いた研究では、軽度認知障害からアルツハイマー病に進行するにつれて、また健常高齢者の同様の画像と比較して、アルツハ イマー病患者における特定の脳領域のサイズの減少が記録されている[91][92]。 Aβプラークと神経原線維のもつれの両方が、アルツハイマー病患者の脳、特に海馬[93]において顕微鏡ではっきりと見える。 しかし、アルツハイマー病は、大脳新皮質において神経原線維のもつれを伴わずに発症することがある[95]。プラークは、神経細胞の外側および周囲にある β-アミロイドペプチドと細胞性物質が密集した、ほとんどが不溶性の沈着物である。もつれ(神経原線維変化)は、リン酸化が進んだ微小管関連タンパク質タ ウの凝集体で、細胞内に蓄積する。多くの高齢者が加齢の結果としてプラークやタングルを発症するが、アルツハイマー病患者の脳では、側頭葉などの特定の脳 領域でより多くのタングルがみられる[96]。レビー小体はアルツハイマー病患者の脳ではまれではない[97]。 生化学 主な論文 アルツハイマー病の生化学  酵素はAPP(アミロイドβ前駆体蛋白)に作用し、それを断片に切断する。βアミロイド断片はアルツハイマー病におけるアミロイド斑の形成に極めて重要で ある。 アルツハイマー病は、異常に折り畳まれたアミロイドβタンパク質がアミロイド斑に、タウタンパク質が神経原線維のもつれに脳内に蓄積することによって引き 起こされる、タンパク質のミスフォールディング病、プロテオパシーとして同定されている[98]。斑は、アミロイドβ(Aβ)と呼ばれる、長さ39-43 アミノ酸の小さなペプチドからできている。アミロイドβは、ニューロン膜を貫通する膜貫通タンパク質である、より大きなアミロイドβ前駆体タンパク質 (APP)の断片である。APPはニューロンの成長、生存、損傷後の修復に重要である。アルツハイマー病では、ガンマセクレターゼとベータセクレターゼが タンパク質分解プロセスで一緒に作用し、APPをより小さな断片に分割させる[101]。 これらの断片の一つがアミロイドベータのフィブリルを生じ、これが塊を形成してアミロイド斑として知られる高密度の形態でニューロンの外側に沈着する [93][102]。 アルツハイマー病は、タウ蛋白質の異常凝集によるタウオパチーとも考えられている。すべての神経細胞には細胞骨格があり、内部支持構造の一部は微小管と呼 ばれる構造でできている。これらの微小管は線路のような役割を果たし、栄養分や分子を細胞本体から軸索の末端まで誘導している。タウと呼ばれるタンパク質 は、リン酸化されると微小管を安定化させるので、微小管関連タンパク質と呼ばれる。アルツハイマー病では、タウは化学変化を起こし、過リン酸化される。そ の後、タウは他の糸と対になり始め、神経原線維のもつれを形成し、ニューロンの輸送系を崩壊させる。 病原性タウはまた、トランスポーザブルエレメントの調節異常によって神経細胞死を引き起こすこともある[104]。 タウのもつれに冒された脳細胞における細胞死のメカニズムとして、ネクロプトーシスも報告されている[105][106]。 疾患メカニズム βアミロイドペプチドの産生と凝集の障害がどのようにしてアルツハイマー病の病態を引き起こすのか、正確にはわかっていない[107][108]。アミロ イド仮説は伝統的に、神経細胞の変性の引き金となる中心的な出来事としてβアミロイドペプチドの蓄積を指摘している。凝集したアミロイド線維の蓄積は、細 胞のカルシウムイオンの恒常性を乱す原因となるタンパク質の毒性形態であると考えられており、プログラムされた細胞死(アポトーシス)を誘導する [109]。また、Aβはアルツハイマー病に罹患した脳の細胞内のミトコンドリアに選択的に蓄積し、特定の酵素機能とニューロンによるグルコースの利用を 阻害することも知られている[110]。 鉄のホメオスタシス異常は疾患の進行と関連しており、フェロプトーシスと呼ばれる鉄依存性の制御された細胞死の形態が関与している可能性がある。脂質過酸 化産物もまた、対照群と比較してADの脳で上昇している[111]。 様々な炎症過程およびサイトカインもまた、アルツハイマー病の病態に関与している可能性がある。炎症は、あらゆる疾患における組織損傷の一般的なマーカー であり、アルツハイマー病における組織損傷の二次的なものであるか、免疫学的反応のマーカーである可能性がある。肥満と全身性の炎症は、疾患の進行を促進 する免疫学的プロセスを阻害する可能性がある [113] 。 アルツハイマー病では、さまざまな神経栄養因子の分布や脳由来神経栄養因子(BDNF)などの受容体の発現の変化が報告されている[114][115]。 |
| Diagnosis See also: Early-onset Alzheimer's disease § Diagnosis 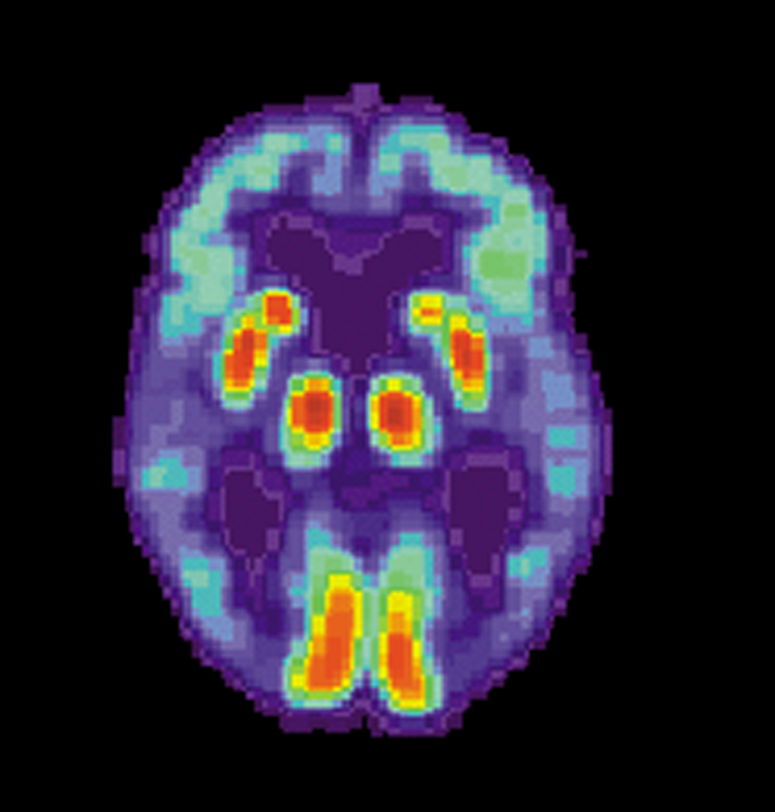 PET scan of the brain of a person with Alzheimer's disease showing a loss of function in the temporal lobe Alzheimer's disease (AD) can only be definitively diagnosed with autopsy findings; in the absence of autopsy, clinical diagnoses of AD are "possible" or "probable", based on other findings.[21][22][116] Up to 23% of those clinically diagnosed with AD may be misdiagnosed and may have pathology suggestive of another condition with symptoms that mimic those of AD.[22] AD is usually clinically diagnosed based on the person's medical history, history from relatives, and behavioral observations. The presence of characteristic neurological and neuropsychological features and the absence of alternative conditions supports the diagnosis.[needs update][117][118] Advanced medical imaging with computed tomography (CT) or magnetic resonance imaging (MRI), and with single-photon emission computed tomography (SPECT) or positron emission tomography (PET), can be used to help exclude other cerebral pathology or subtypes of dementia.[119] Moreover, it may predict conversion from prodromal stages (mild cognitive impairment) to Alzheimer's disease.[120] FDA-approved radiopharmaceutical diagnostic agents used in PET for Alzheimer's disease are florbetapir (2012), flutemetamol (2013), florbetaben (2014), and flortaucipir (2020).[121] Because many insurance companies in the United States do not cover this procedure, its use in clinical practice is largely limited to clinical trials as of 2018.[122] Assessment of intellectual functioning including memory testing can further characterise the state of the disease.[1] Medical organizations have created diagnostic criteria to ease and standardise the diagnostic process for practising physicians. Definitive diagnosis can only be confirmed with post-mortem evaluations when brain material is available and can be examined histologically for senile plaques and neurofibrillary tangles.[122][123] Criteria There are three sets of criteria for the clinical diagnoses of the spectrum of Alzheimer's disease: the 2013 fifth edition of the Diagnostic and Statistical Manual of Mental Disorders (DSM-5); the National Institute on Aging-Alzheimer's Association (NIA-AA) definition as revised in 2011; and the International Working Group criteria as revised in 2010.[38][122] Three broad time periods, which can span decades, define the progression of Alzheimer's disease from the preclinical phase, to mild cognitive impairment (MCI), followed by Alzheimer's disease dementia.[124] Eight intellectual domains are most commonly impaired in AD—memory, language, perceptual skills, attention, motor skills, orientation, problem solving and executive functional abilities, as listed in the fourth text revision of the DSM (DSM-IV-TR).[125] The DSM-5 defines criteria for probable or possible Alzheimer's for both major and mild neurocognitive disorder.[126][127][116] Major or mild neurocognitive disorder must be present along with at least one cognitive deficit for a diagnosis of either probable or possible AD.[126][128] For major neurocognitive disorder due to Alzheimer's disease, probable Alzheimer's disease can be diagnosed if the individual has genetic evidence of Alzheimer's[129] or if two or more acquired cognitive deficits, and a functional disability that is not from another disorder, are present.[130] Otherwise, possible Alzheimer's disease can be diagnosed as the diagnosis follows an atypical route.[131] For mild neurocognitive disorder due to Alzheimer's, probable Alzheimer's disease can be diagnosed if there is genetic evidence, whereas possible Alzheimer's disease can be met if all of the following are present: no genetic evidence, decline in both learning and memory, two or more cognitive deficits, and a functional disability not from another disorder.[126][132] The NIA-AA criteria are used mainly in research rather than in clinical assessments.[133] They define Alzheimer's disease through three major stages: preclinical, mild cognitive impairment (MCI), and Alzheimer's dementia.[134][135] Diagnosis in the preclinical stage is complex and focuses on asymptomatic individuals;[135][136] the latter two stages describe individuals experiencing symptoms.[135] The core clinical criteria for MCI is used along with identification of biomarkers,[137] predominantly those for neuronal injury (mainly tau-related) and amyloid beta deposition.[133][135] The core clinical criteria itself rests on the presence of cognitive impairment[135] without the presence of comorbidities.[138][139] The third stage is divided into probable and possible Alzheimer's disease dementia.[139] In probable Alzheimer's disease dementia there is steady impairment of cognition over time and a memory-related or non-memory-related cognitive dysfunction.[139] In possible Alzheimer's disease dementia, another causal disease such as cerebrovascular disease is present.[139] Techniques 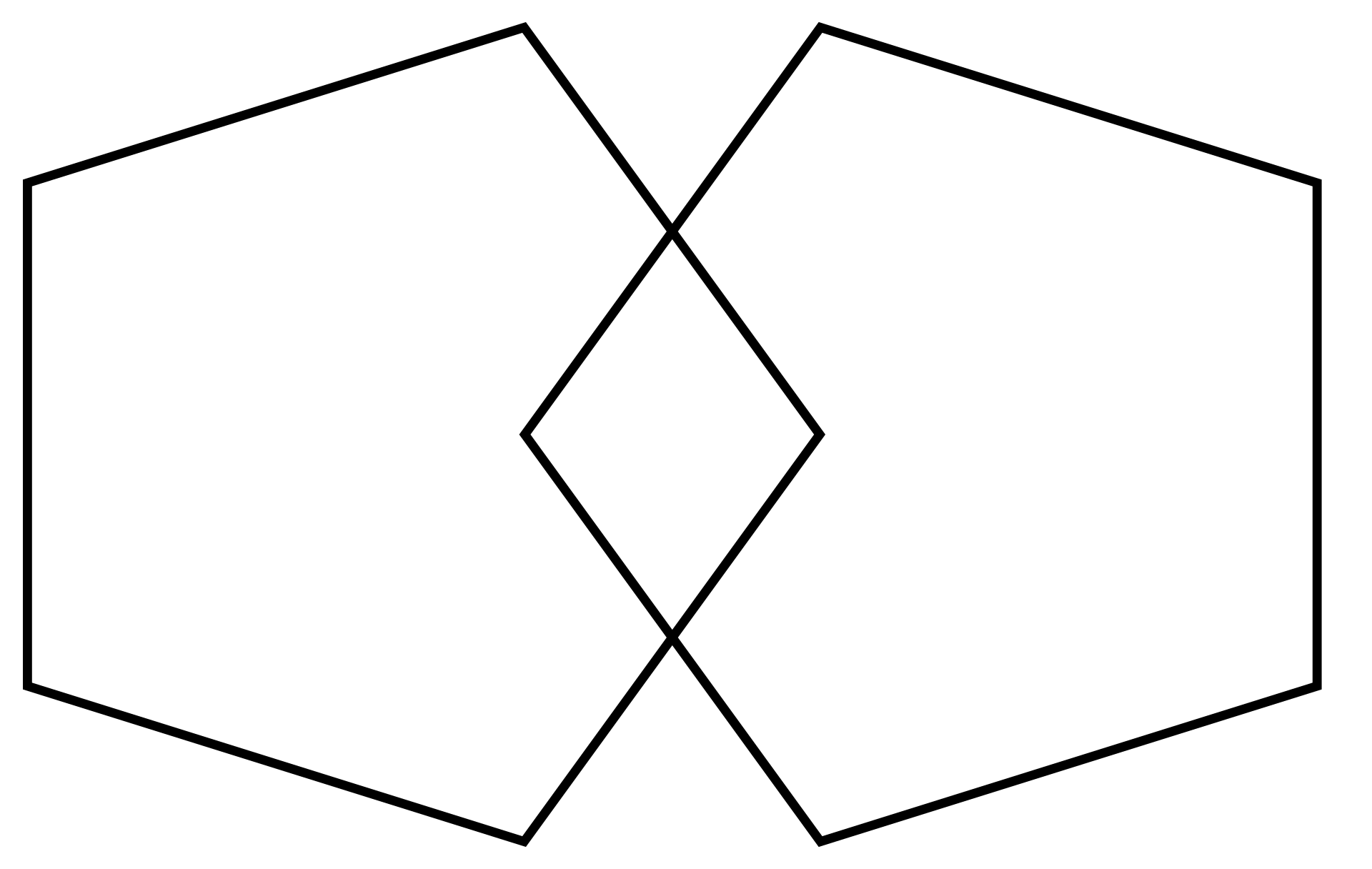 Cognitive tests such as the mini–mental state examination (MMSE) can help in the diagnosis of Alzheimer's disease. In this test instructions are given to copy drawings like the one shown, remember some words, read, and subtract numbers serially. Neuropsychological tests including cognitive tests such as the mini–mental state examination (MMSE), the Montreal Cognitive Assessment (MoCA) and the Mini-Cog are widely used to aid in diagnosis of the cognitive impairments in AD.[140] These tests may not always be accurate, as they lack sensitivity to mild cognitive impairment, and can be biased by language or attention problems;[140] more comprehensive test arrays are necessary for high reliability of results, particularly in the earliest stages of the disease.[141][142] Further neurological examinations are crucial in the differential diagnosis of Alzheimer's disease and other diseases.[32] Interviews with family members are used in assessment; caregivers can supply important information on daily living abilities and on the decrease in the person's mental function.[143] A caregiver's viewpoint is particularly important, since a person with Alzheimer's disease is commonly unaware of their deficits.[144] Many times, families have difficulties in the detection of initial dementia symptoms and may not communicate accurate information to a physician.[145] Supplemental testing can rule out other potentially treatable diagnoses and help avoid misdiagnoses.[146] Common supplemental tests include blood tests, thyroid function tests, as well as tests to assess vitamin B12 levels, rule out neurosyphilis and rule out metabolic problems (including tests for kidney function, electrolyte levels and for diabetes).[146] MRI or CT scans might also be used to rule out other potential causes of the symptoms – including tumors or strokes.[140] Delirium and depression can be common among individuals and are important to rule out.[147] Psychological tests for depression are used, since depression can either be concurrent with Alzheimer's disease (see Depression of Alzheimer disease), an early sign of cognitive impairment,[148] or even the cause.[149][150] Due to low accuracy, the C-PIB-PET scan is not recommended as an early diagnostic tool or for predicting the development of Alzheimer's disease when people show signs of mild cognitive impairment (MCI).[151] The use of 18F-FDG PET scans, as a single test, to identify people who may develop Alzheimer's disease is not supported by evidence.[152] |
診断 以下も参照: 早期発症アルツハイマー病 § 診断  側頭葉の機能低下を示すアルツハイマー病患者の脳のPETスキャン アルツハイマー病(AD)は、剖検所見によってのみ確定診断できる;剖検がない場合、ADの臨床診断は、他の所見に基づいて「可能性がある」または「可能 性が高い」とされる[21][22][116]。ADと臨床診断された人の最大23%は誤診されることがあり、ADに類似した症状を呈する他の疾患を示唆 する病理所見を有することがある[22]。 ADは通常、患者の病歴、親族からの病歴、および行動観察に基づいて臨床的に診断される。特徴的な神経学的および神経心理学的特徴が存在し、代替疾患がな いことが診断の根拠となる[要更新][117][118]。コンピュータ断層撮影法(CT)または磁気共鳴画像法(MRI)、単一光子放射型コンピュータ 断層撮影法(SPECT)または陽電子放射断層撮影法(PET)を用いた高度医療画像診断は、他の大脳病理または認知症の亜型の除外に役立つ。 [119] さらに、前駆期(軽度認知障害)からアルツハイマー病への転換を予測することができる。 [120] アルツハイマー病に対するPETで使用されるFDA承認の放射性医薬品診断薬は、フロルベタピル(2012年)、フルテメタモール(2013年)、フロル ベタベン(2014年)、およびフロルタウシピル(2020年)である。 記憶検査を含む知的機能の評価は、疾患の状態をさらに特徴づけることができる[1]。医療機関は、開業医の診断プロセスを容易にし、標準化するために診断 基準を作成している。確定診断は、脳の材料が入手可能で、老人斑や神経原線維変化を組織学的に調べることができる場合、死後評価によってのみ確認できる [122][123]。 判定基準 精神疾患の診断と統計マニュアル(DSM-5)の2013年第5版、2011年に改訂された米国老化研究所-アルツハイマー病協会(NIA-AA)の定 義、および2010年に改訂された国際ワーキンググループの基準である。 [38] [122] 前臨床期から軽度認知障害(MCI)、そしてアルツハイマー病認知症へと続くアルツハイマー病の進行は、数十年に及ぶ3つの広範な期間によって定義される [124]。 DSMの第4版(DSM-IV-TR)に記載されているように、記憶、言語、知覚技能、注意、運動技能、方向感覚、問題解決および実行機能能力の8つの知 的領域がADにおいて最も一般的に障害される[125]。 DSM-5では、主要な神経認知障害と軽度の神経認知障害の両方について、アルツハイマー型認知症の可能性が高い、または可能性があるという基準を定義し ている[126][127][116]。ADの可能性が高い、または可能性があるという診断のためには、主要な神経認知障害または軽度の神経認知障害が、 少なくとも1つの認知障害とともに存在しなければならない。 [126][128]アルツハイマー病による大神経認知障害については、アルツハイマー病の遺伝的証拠[129]がある場合、または2つ以上の後天的な認 知障害、および他の障害によるものではない機能障害が存在する場合に、アルツハイマー病の可能性があると診断できる。 [130] そうでなければ、診断が非典型的な経路をたどるため、アルツハイマー病の可能性があると診断されうる[131]。 アルツハイマー病による軽度神経認知障害については、遺伝的証拠があればアルツハイマー病の可能性が高いと診断されうるが、遺伝的証拠がないこと、学習と 記憶の両方が低下していること、2つ以上の認知障害があること、他の障害に起因しない機能障害があることのすべてが存在すれば、アルツハイマー病の可能性 があると診断されうる[126][132]。 NIA-AA基準は、主に臨床評価よりも研究において使用されている[133]。彼らは、前臨床期、軽度認知障害(MCI)、アルツハイマー型認知症の3 つの主要な段階を通してアルツハイマー病を定義している。 [134][135]前臨床段階における診断は複雑であり、無症状の個人に焦点を当てる[135][136]。後者の2つの段階は、症状を経験している個 人を記述する[135]。MCIの中核的臨床基準は、主に神経細胞傷害(主にタウ関連)とアミロイドβ沈着のバイオマーカー[137]の同定とともに使用 される。 [133][135]中核的臨床基準そのものは、併存疾患の存在を伴わない認知障害[135]の存在にかかっている[138][139]。 [139]アルツハイマー型認知症の可能性が高い場合は、長期にわたる認知の安定した障害と、記憶に関連したまたは記憶に関連しない認知機能障害がある [139]。アルツハイマー型認知症の可能性が高い場合は、脳血管疾患などの別の原因疾患が存在する[139]。 検査法  ミニ精神状態検査(MMSE)などの認知機能検査は、アルツハイマー病の診断に役立つ。この検査では、図のような絵の模写、いくつかの単語の記憶、読書、 数字の連続的な引き算などの指示が与えられる。 ミニ精神状態検査(MMSE)、Montreal Cognitive Assessment(MoCA)、Mini-Cogなどの認知機能検査を含む神経心理学的検査は、ADにおける認知機能障害の診断に広く用いられている [140]。これらの検査は、軽度の認知機能障害に対する感度が低く、言語または注意の問題によって偏りが生じることがあるため、必ずしも正確であるとは 限らない[140];特に疾患の初期段階において、結果の高い信頼性を得るためには、より包括的な検査アレイが必要である[141][142]。 アルツハイマー病と他の疾患との鑑別診断には、さらなる神経学的検査が重要である[32]。 評価には家族との面接が用いられる。介護者は、日常生活能力や本人の精神機能の低下に関する重要な情報を提供することができる[143]。 アルツハイマー病患者は一般的に自分の障害に気づいていないことが多いため、介護者の視点は特に重要である[144]。 一般的な補助検査には、血液検査、甲状腺機能検査、ビタミンB12レベルの評価、神経梅毒の除外、代謝異常の除外(腎機能、電解質レベル、糖尿病の検査を 含む)などがある。 [146] MRIまたはCTスキャンは、腫瘍や脳卒中など、症状の他の潜在的な原因を除外するためにも使用されることがある。 [140] せん妄やうつ病は、個人間でよくみられることがあり、除外することが重要である。 うつ病は、アルツハイマー病(アルツハイマー病のうつ病を参照)、認知機能障害の初期徴候[148]、または原因である可能性があるため、うつ病の心理テ ストが使用される[149][150]。 精度が低いため、C-PIB-PETスキャンは、早期診断ツールとして、または軽度認知障害(MCI)の徴候がみられる場合のアルツハイマー病の発症の予 測としては推奨されない[151]。 18F-FDG-PETスキャンを単独検査としてアルツハイマー病を発症する可能性のある人を同定するために使用することは、証拠によって支持されていな い[152]。 |
Prevention Intellectual activities such as playing chess or regular social interaction have been linked to a reduced risk of Alzheimer's disease in epidemiological studies, although no causal relationship has been found. There are no disease-modifying treatments available to cure Alzheimer's disease and because of this, AD research has focused on interventions to prevent the onset and progression.[153] There is no evidence that supports any particular measure in preventing Alzheimer's,[1] and studies of measures to prevent the onset or progression have produced inconsistent results. Epidemiological studies have proposed relationships between an individual's likelihood of developing AD and modifiable factors, such as medications, lifestyle, and diet. There are some challenges in determining whether interventions for Alzheimer's disease act as a primary prevention method, preventing the disease itself, or a secondary prevention method, identifying the early stages of the disease.[154] These challenges include duration of intervention, different stages of disease at which intervention begins, and lack of standardization of inclusion criteria regarding biomarkers specific for Alzheimer's disease.[154] Further research is needed to determine factors that can help prevent Alzheimer's disease.[154] Medication Cardiovascular risk factors, such as hypercholesterolaemia, hypertension, diabetes, and smoking, are associated with a higher risk of onset and worsened course of AD.[155][156] The use of statins to lower cholesterol may be of benefit in Alzheimer's.[157] Antihypertensive and antidiabetic medications in individuals without overt cognitive impairment may decrease the risk of dementia by influencing cerebrovascular pathology.[1][158] More research is needed to examine the relationship with Alzheimer's disease specifically; clarification of the direct role medications play versus other concurrent lifestyle changes (diet, exercise, smoking) is needed.[1] Depression is associated with an increased risk for Alzheimer's disease; management with antidepressants may provide a preventative measure.[5] Historically, long-term usage of non-steroidal anti-inflammatory drugs (NSAIDs) were thought to be associated with a reduced likelihood of developing Alzheimer's disease as it reduces inflammation; however, NSAIDs do not appear to be useful as a treatment.[122] Additionally, because women have a higher incidence of Alzheimer's disease than men, it was once thought that estrogen deficiency during menopause was a risk factor. However, there is a lack of evidence to show that hormone replacement therapy (HRT) in menopause decreases risk of cognitive decline.[159] Lifestyle Further information: Neurobiological effects of physical exercise Certain lifestyle activities, such as physical and cognitive exercises, higher education and occupational attainment, cigarette smoking, stress, sleep, and the management of other comorbidities, including diabetes and hypertension, may affect the risk of developing Alzheimer's.[5] Physical exercise is associated with a decreased rate of dementia,[6] and is effective in reducing symptom severity in those with AD.[160] Memory and cognitive functions can be improved with aerobic exercises including brisk walking three times weekly for forty minutes.[161] It may also induce neuroplasticity of the brain.[162] Participating in mental exercises, such as reading, crossword puzzles, and chess have shown a potential to be preventative.[5] Meeting the WHO recommendations for physical activity is associated with a lower risk of AD.[163] Higher education and occupational attainment, and participation in leisure activities, contribute to a reduced risk of developing Alzheimer's,[7] or of delaying the onset of symptoms. This is compatible with the cognitive reserve theory, which states that some life experiences result in more efficient neural functioning providing the individual a cognitive reserve that delays the onset of dementia manifestations.[7] Education delays the onset of Alzheimer's disease syndrome without changing the duration of the disease.[164] Cessation in smoking may reduce risk of developing Alzheimer's' disease, specifically in those who carry APOE ɛ4 allele.[165][5] The increased oxidative stress caused by smoking results in downstream inflammatory or neurodegenerative processes that may increase risk of developing AD.[166] Avoidance of smoking, counseling and pharmacotherapies to quit smoking are used, and avoidance of environmental tobacco smoke is recommended.[5] Alzheimer's disease is associated with sleep disorders but the precise relationship is unclear.[167][168] It was once thought that as people get older, the risk of developing sleep disorders and AD independently increase, but research is examining whether sleep disorders may increase the prevalence of AD.[167] One theory is that the mechanisms to increase clearance of toxic substances, including Aβ, are active during sleep.[167][169] With decreased sleep, a person is increasing Aβ production and decreasing Aβ clearance, resulting in Aβ accumulation.[170][167][168] Receiving adequate sleep (approximately 7–8 hours) every night has become a potential lifestyle intervention to prevent the development of AD.[5] Stress is a risk factor for the development of Alzheimer's.[5] The mechanism by which stress predisposes someone to development of Alzheimer's is unclear, but it is suggested that lifetime stressors may affect a person's epigenome, leading to an overexpression or under expression of specific genes.[171] Although the relationship of stress and Alzheimer's is unclear, strategies to reduce stress and relax the mind may be helpful strategies in preventing the progression or Alzheimer's disease.[172] Meditation, for instance, is a helpful lifestyle change to support cognition and well-being, though further research is needed to assess long-term effects.[162] |
予防 チェスのような知的活動や定期的な社会的交流は、疫学的研究においてアルツハイマー病のリスク低下と関連しているが、因果関係は認められていない。 アルツハイマー病を治癒するために利用可能な疾患修飾治療はなく、このため、AD研究は発症および進行を予防するための介入に焦点を当てている [153]。アルツハイマー病を予防するための特定の対策を支持する証拠はなく[1]、発症または進行を予防するための対策に関する研究では一貫性のない 結果が得られている。疫学研究では、個人のAD発症の可能性と薬物、生活様式、食事などの修正可能な因子との関係が提唱されている。アルツハイマー病に対 する介入が、疾患そのものを予防する一次予防法として作用するのか、疾患の初期段階を同定する二次予防法として作用するのかを決定するには、いくつかの課 題がある[154]。これらの課題には、介入の期間、介入を開始する疾患の病期の違い、アルツハイマー病に特異的なバイオマーカーに関する組み入れ基準の 標準化の欠如などがある[154]。アルツハイマー病の予防に役立つ因子を決定するには、さらなる研究が必要である[154]。 薬物療法 高コレステロール血症、高血圧、糖尿病、喫煙などの心血管危険因子は、ADの発症および経過の悪化の高いリスクと関連している[155][156]。 [157] 顕著な認知障害のない患者における降圧薬および抗糖尿病薬は、脳血管病理学に影響を及ぼすことによって認知症のリスクを低下させる可能性がある[1] [158]。アルツハイマー病との関係を具体的に検討するためには、さらなる研究が必要である;薬物が果たす直接的な役割と他の同時的な生活様式の変化 (食事、運動、喫煙)との比較の解明が必要である[1]。 うつ病はアルツハイマー病のリスク増加と関連しており、抗うつ薬による管理は予防策となりうる[5]。 歴史的に、非ステロイド性抗炎症薬(NSAIDs)の長期使用は、炎症を抑制するためアルツハイマー病の発症可能性の低下と関連していると考えられていた が、NSAIDsは治療として有用ではないようである[122]。さらに、女性は男性よりもアルツハイマー病の発症率が高いため、かつては閉経期のエスト ロゲン欠乏が危険因子であると考えられていた。しかしながら、閉経期のホルモン補充療法(HRT)が認知機能低下のリスクを低下させることを示す証拠は不 足している[159]。 ライフスタイル さらなる情報: 身体運動の神経生物学的効果 身体運動や認知運動、高等教育や職業達成、喫煙、ストレス、睡眠、糖尿病や高血圧などの他の併存疾患の管理などの特定の生活習慣は、アルツハイマー病の発 症リスクに影響を及ぼす可能性がある[5]。 身体運動は認知症の発症率の低下と関連しており[6]、AD患者の症状の重症度を軽減するのに有効である[160]。記憶および認知機能は、週3回、40 分間の早歩きを含む有酸素運動によって改善することができる[161]。また、脳の神経可塑性を誘発する可能性もある[162]。読書、クロスワードパズ ル、チェスなどの頭の体操に参加することは、予防の可能性を示している[5]。 高学歴、高職業、余暇活動への参加は、アルツハイマー病の発症リスクの低下[7]、または症状の発現の遅延に寄与する。このことは、いくつかの人生経験に より、より効率的な神経機能が個人に認知症症状の発現を遅らせる認知的予備能を提供するという認知的予備理論に適合する[7]。教育により、アルツハイ マー病の罹病期間を変えることなく、アルツハイマー病症候群の発現が遅れる[164]。 禁煙は、特にAPOE ɛ4対立遺伝子を有する人において、アルツハイマー病の発症リスクを低下させる可能性がある[165][5]。喫煙によって引き起こされる酸化ストレスの 増加は、AD発症リスクを増加させる可能性のある下流の炎症または神経変性過程をもたらす[166]。禁煙のための回避、カウンセリング、薬物療法が用い られ、環境タバコ煙の回避が推奨される[5]。 アルツハイマー病は睡眠障害と関連しているが、正確な関係は不明である[167][168]。かつては、高齢になるにつれて、睡眠障害の発症リスクとAD の発症リスクは独立して増加すると考えられていたが、睡眠障害がADの有病率を増加させるかどうかについて研究が進められている。 [167]一説によると、Aβを含む有害物質のクリアランスを増加させるメカニズムが睡眠中に活性化される[167][169]。睡眠が減少すると、人は Aβの産生を増加させ、Aβのクリアランスを減少させることになり、結果としてAβが蓄積する[170][167][168]。毎晩十分な睡眠(約7~8 時間)をとることが、ADの発症を予防するための潜在的な生活習慣介入となっている[5]。 ストレスはアルツハイマー病発症の危険因子である[5]。ストレスがアルツハイマー病発症の素因となる機序は不明であるが、生涯のストレス因子が人のエピ ゲノムに影響を及ぼし、特定の遺伝子の過剰発現または過小発現につながる可能性が示唆されている。 [171] ストレスとアルツハイマー病の関係は不明であるが、ストレスを軽減し、心をリラックスさせる戦略は、アルツハイマー病の進行を予防する上で有用な戦略であ る可能性がある[172]。例えば、瞑想は、長期的な効果を評価するためにさらなる研究が必要であるが、認知と幸福を支援するために有用なライフスタイル の変化である[162]。 |
| Management There is no cure for Alzheimer's disease;[173] available treatments offer relatively small symptomatic benefits but remain palliative in nature.[14][174] Treatments can be divided into pharmaceutical, psychosocial, and caregiving. Pharmaceutical  Three-dimensional molecular model of donepezil, an acetylcholinesterase inhibitor used in the treatment of Alzheimer's disease symptoms  Molecular structure of memantine, a medication approved for advanced Alzheimer's disease symptoms Medications used to treat the cognitive symptons of Alzheimer's disease rather than the underlying cause include: four acetylcholinesterase inhibitors (tacrine, rivastigmine, galantamine, and donepezil) and memantine, an NMDA receptor antagonist. The acetylcholinesterase inhibitors are intended for those with mild to severe Alzheimer's, whereas memantine is intended for those with moderate or severe Alzheimer's disease.[122] The benefit from their use is small.[175][176][177][15] Reduction in the activity of the cholinergic neurons is a well-known feature of Alzheimer's disease.[178] Acetylcholinesterase inhibitors are employed to reduce the rate at which acetylcholine (ACh) is broken down, thereby increasing the concentration of ACh in the brain and combating the loss of ACh caused by the death of cholinergic neurons.[179] There is evidence for the efficacy of these medications in mild to moderate Alzheimer's disease,[180][175] and some evidence for their use in the advanced stage.[175] The use of these drugs in mild cognitive impairment has not shown any effect in a delay of the onset of Alzheimer's disease.[181] The most common side effects are nausea and vomiting, both of which are linked to cholinergic excess. These side effects arise in approximately 10–20% of users, are mild to moderate in severity, and can be managed by slowly adjusting medication doses.[182] Less common secondary effects include muscle cramps, decreased heart rate (bradycardia), decreased appetite and weight, and increased gastric acid production.[180] Glutamate is an excitatory neurotransmitter of the nervous system, although excessive amounts in the brain can lead to cell death through a process called excitotoxicity which consists of the overstimulation of glutamate receptors. Excitotoxicity occurs not only in Alzheimer's disease, but also in other neurological diseases such as Parkinson's disease and multiple sclerosis.[183] Memantine is a noncompetitive NMDA receptor antagonist first used as an anti-influenza agent. It acts on the glutamatergic system by blocking NMDA receptors and inhibiting their overstimulation by glutamate.[183][184] Memantine has been shown to have a small benefit in the treatment of moderate to severe Alzheimer's disease.[185] Reported adverse events with memantine are infrequent and mild, including hallucinations, confusion, dizziness, headache and fatigue.[186][187] The combination of memantine and donepezil[188] has been shown to be "of statistically significant but clinically marginal effectiveness".[189] An extract of Ginkgo biloba known as EGb 761 has been used for treating Alzheimer's and other neuropsychiatric disorders.[190] Its use is approved throughout Europe.[191] The World Federation of Biological Psychiatry guidelines lists EGb 761 with the same weight of evidence (level B) given to acetylcholinesterase inhibitors and memantine. EGb 761 is the only one that showed improvement of symptoms in both Alzheimer's disease and vascular dementia. EGb 761 may have a role either on its own or as an add-on if other therapies prove ineffective.[190] A 2016 review concluded that the quality of evidence from clinical trials on Ginkgo biloba has been insufficient to warrant its use for treating Alzheimer's disease.[192] Atypical antipsychotics are modestly useful in reducing aggression and psychosis in people with Alzheimer's disease, but their advantages are offset by serious adverse effects, such as stroke, movement difficulties or cognitive decline.[193] When used in the long-term, they have been shown to associate with increased mortality.[194] Stopping antipsychotic use in this group of people appears to be safe.[195] Psychosocial Psychosocial interventions are used as an adjunct to pharmaceutical treatment and can be classified within behavior-, emotion-, cognition- or stimulation-oriented approaches.[needs update][196] Behavioral interventions attempt to identify and reduce the antecedents and consequences of problem behaviors. This approach has not shown success in improving overall functioning,[197] but can help to reduce some specific problem behaviors, such as incontinence.[198] There is a lack of high quality data on the effectiveness of these techniques in other behavior problems such as wandering.[199][200] Music therapy is effective in reducing behavioral and psychological symptoms.[201] Emotion-oriented interventions include reminiscence therapy, validation therapy, supportive psychotherapy, sensory integration, also called snoezelen, and simulated presence therapy. A Cochrane review has found no evidence that this is effective.[202] Reminiscence therapy (RT) involves the discussion of past experiences individually or in group, many times with the aid of photographs, household items, music and sound recordings, or other familiar items from the past. A 2018 review of the effectiveness of RT found that effects were inconsistent, small in size and of doubtful clinical significance, and varied by setting.[203] Simulated presence therapy (SPT) is based on attachment theories and involves playing a recording with voices of the closest relatives of the person with Alzheimer's disease. There is partial evidence indicating that SPT may reduce challenging behaviors.[204] The aim of cognition-oriented treatments, which include reality orientation and cognitive retraining, is the reduction of cognitive deficits. Reality orientation consists of the presentation of information about time, place, or person to ease the understanding of the person about its surroundings and his or her place in them. On the other hand, cognitive retraining tries to improve impaired capacities by exercising mental abilities. Both have shown some efficacy improving cognitive capacities.[205] Stimulation-oriented treatments include art, music and pet therapies, exercise, and any other kind of recreational activities. Stimulation has modest support for improving behavior, mood, and, to a lesser extent, function. Nevertheless, as important as these effects are, the main support for the use of stimulation therapies is the change in the person's routine.[196] Caregiving Further information: Caring for people with dementia and Palliative care Since Alzheimer's has no cure and it gradually renders people incapable of tending to their own needs, caregiving is essentially the treatment and must be carefully managed over the course of the disease. During the early and moderate stages, modifications to the living environment and lifestyle can increase safety and reduce caretaker burden.[206][207] Examples of such modifications are the adherence to simplified routines, the placing of safety locks, the labeling of household items to cue the person with the disease or the use of modified daily life objects.[196][208][209] If eating becomes problematic, food will need to be prepared in smaller pieces or even puréed.[210] When swallowing difficulties arise, the use of feeding tubes may be required. In such cases, the medical efficacy and ethics of continuing feeding is an important consideration of the caregivers and family members.[211][212] The use of physical restraints is rarely indicated in any stage of the disease, although there are situations when they are necessary to prevent harm to the person with Alzheimer's disease or their caregivers.[196] During the final stages of the disease, treatment is centred on relieving discomfort until death, often with the help of hospice.[213] Diet Diet may be a modifiable risk factor for the development of Alzheimer's disease. The Mediterranean diet, and the DASH diet are both associated with less cognitive decline. A different approach has been to incorporate elements of both of these diets into one known as the MIND diet.[214] Studies of individual dietary components, minerals and supplements are conflicting as to whether they prevent AD or cognitive decline.[214] Prognosis The early stages of Alzheimer's disease are difficult to diagnose. A definitive diagnosis is usually made once cognitive impairment compromises daily living activities, although the person may still be living independently. The symptoms will progress from mild cognitive problems, such as memory loss through increasing stages of cognitive and non-cognitive disturbances, eliminating any possibility of independent living, especially in the late stages of the disease.[39] Life expectancy of people with Alzheimer's disease is reduced.[215] The normal life expectancy for 60 to 70 years old is 23 to 15 years; for 90 years old it is 4.5 years.[216] Following Alzheimer's disease diagnosis it ranges from 7 to 10 years for those in their 60s and early 70s (a loss of 13 to 8 years), to only about 3 years or less (a loss of 1.5 years) for those in their 90s.[215] Fewer than 3% of people live more than fourteen years after diagnosis.[217] Disease features significantly associated with reduced survival are an increased severity of cognitive impairment, decreased functional level, disturbances in the neurological examination, history of falls, malnutrition, dehydration and weight loss.[3] Other coincident diseases such as heart problems, diabetes, or history of alcohol abuse are also related with shortened survival.[218][219][220] While the earlier the age at onset the higher the total survival years, life expectancy is particularly reduced when compared to the healthy population among those who are younger.[221] Men have a less favourable survival prognosis than women.[needs update][217][222] Aspiration pneumonia is the most frequent immediate cause of death brought by Alzheimer's disease.[3] While the reasons behind the lower prevalence of cancer in Alzheimer's patients remain unclear, some researchers hypothesize that biological mechanisms shared by both diseases might play a role. However, this requires further investigation.[223] |
管理 アルツハイマー病には治療法がない。[173] 利用可能な治療法は、比較的小さな対症療法的効果をもたらすが、本質的には緩和的なものにとどまる。[14] [174] 治療法は、薬物療法、心理社会的療法、介護療法に分けられる。 薬物療法  アルツハイマー病の症状治療に用いられるアセチルコリンエステラーゼ阻害薬ドネペジルの3次元分子モデル  進行したアルツハイマー病の症状の治療薬として承認されているメマンチンの分子構造 アルツハイマー病の根本的な原因ではなく、認知症状の治療に用いられる薬には、4種類のアセチルコリンエステラーゼ阻害薬(タクリン、リバスチグミン、ガ ランタミン、ドネペジル)とNMDA受容体拮抗薬のメマンチンがある。アセチルコリンエステラーゼ阻害薬は軽度から重度のアルツハイマー病患者を対象とし ているのに対し、メマンチンは中等度または重度のアルツハイマー病患者を対象としている[122]。これらの使用による利益は小さい[175][176] [177][15]。 アセチルコリンエステラーゼ阻害薬は、アセチルコリン(ACh)が分解される速度を低下させることにより、脳内のACh濃度を増加させ、コリン作動性 ニューロンの死によって引き起こされるAChの損失に対抗するために使用される。 [179] 軽度から中等度のアルツハイマー病におけるこれらの薬剤の有効性については証拠があり[180][175]、進行期における使用については若干の証拠があ る[175]。軽度認知障害におけるこれらの薬剤の使用は、アルツハイマー病の発症を遅らせる効果を示していない[181]。これらの副作用は、使用者の 約10~20%に発現し、重症度は軽度から中等度であり、薬の用量をゆっくりと調節することで管理できる。[182] あまり一般的でない副次的作用には、筋肉のけいれん、心拍数の減少(徐脈)、食欲および体重の減少、胃酸分泌の増加がある。 グルタミン酸は神経系の興奮性神経伝達物質であるが、脳内で過剰になると、グルタミン酸受容体の過剰刺激からなる興奮毒性と呼ばれる過程を経て細胞死に至 ることがある。興奮毒性はアルツハイマー病だけでなく、パーキンソン病や多発性硬化症などの他の神経疾患でも起こる。メマンチンは、NMDA受容体を遮断 し、グルタミン酸による過剰刺激を阻害することにより、グルタミン酸作動性系に作用する[183][184]。 [185]。メマンチンにより報告された有害事象は、幻覚、錯乱、めまい、頭痛、疲労など、頻度が低く軽度である[186][187]。メマンチンとドネ ペジル[188]の併用は、「統計学的に有意であるが、臨床的にはわずかな有効性」であることが示されている[189]。 EGb761として知られるイチョウ葉の抽出物は、アルツハイマー病および他の神経精神障害の治療に使用されている。 その使用はヨーロッパ全域で承認されている[190] 。世界生物学的精神医学連合のガイドラインでは、EGb761はアセチルコリンエステラーゼ阻害薬およびメマンチンと同じ証拠の重み(レベルB)を与えら れている。EGb 761は、アルツハイマー病と血管性認知症の両方で症状の改善を示した唯一の薬剤である。2016年のレビューでは、イチョウ葉に関する臨床試験のエビデ ンスの質は、アルツハイマー病の治療に使用することを保証するには不十分であると結論づけられた[192]。 非定型抗精神病薬は、アルツハイマー病患者における攻撃性および精神病の軽減にそこそこ有用であるが、その利点は、脳卒中、運動障害または認知機能低下な どの重篤な副作用によって相殺される[193]。 心理社会的介入 心理社会的介入は薬物治療の補助として用いられ、行動指向、情動指向、認知指向、刺激指向のアプローチに分類できる[要更新][196]。 行動介入は、問題行動の先行要因と結果を同定し、それを軽減しようとするものである。このアプローチは、全体的な機能の改善には成功を示していないが [197] 、失禁などの特定の問題行動の軽減には役立つことがある [198] 。徘徊などの他の行動問題におけるこれらの技術の有効性については、質の高いデータが不足している [199] [200] 。 情動志向の介入には、回想療法、妥当性確認療法、支持的心理療法、スノーズレンとも呼ばれる感覚統合、模擬臨場感療法などがある。コクラン (Cochrane)のレビューでは、これが有効であるという証拠は見つかっていない。202]回想療法(Reminiscence therapy:RT)には、過去の経験を個人または集団で話し合うことが含まれ、多くの場合、写真、日用品、音楽、録音、その他過去の身近なものを用い て行われる。RTの有効性に関する2018年のレビューによると、効果は一貫しておらず、規模が小さく臨床的意義が疑わしいこと、および設定によって異な ることが明らかにされた[203]。模擬臨場感療法(SPT)は、愛着理論に基づいており、アルツハイマー病患者の近親者の声の録音を再生する。SPTが 挑戦的行動を減少させうることを示す部分的証拠がある [204] 。 現実志向および認知再訓練を含む認知志向の治療の目的は、認知欠損の軽減である。現実志向は、時間、場所、または人に関する情報を提示して、周囲の環境と その中での自分の位置についての本人の理解を容易にするものである。一方、認知的再教育は、精神的能力を行使することによって、損なわれた能力を改善しよ うとするものである。両者とも、認知能力を改善する一定の効果を示している[205]。 刺激志向の治療には、芸術、音楽、ペット療法、運動、その他あらゆる種類のレクリエーション活動が含まれる。刺激療法は、行動、気分、そしてより低い程度 ではあるが機能の改善に対して、ささやかな支持を得ている。とはいえ、これらの効果が重要であるのと同様に、刺激療法を用いる主な支持は、患者の日常生活 の変化である [196] 。 介護 さらに詳しい情報 認知症の人の介護と緩和ケア アルツハイマー型認知症には治療法がなく、徐々に自分の世話ができなくなるため、介護は基本的に治療であり、病気の経過を注意深く管理する必要がある。 初期および中等度の段階では、生活環境および生活様式を修正することで安全性を高め、介護者の負担を軽減することができる。そのような修正の例としては、 簡略化された日課の遵守、安全錠の設置、病気の人の合図となるような日用品のラベリング、または修正された日常生活用具の使用などがある[196] [208][209]。食事に問題が生じるようになった場合は、食べ物を小さく切って調理するか、ピューレ状にする必要がある[210]。このような場 合、栄養補給を継続することの医学的有効性と倫理性は、介護者および家族の重要な考慮事項である。 211][212] 身体拘束の使用は、アルツハイマー病患者またはその介護者への危害を防止するために必要な状況はあるが、疾患のどの段階においても適応されることはまれで ある[196]。 疾患の最終段階では、治療は、しばしばホスピスの助けを借りて、死に至るまで不快感を和らげることに重点が置かれる[213]。 食事療法 食事はアルツハイマー病の発症に対する修正可能な危険因子である可能性がある。地中海食およびDASH食は、いずれも認知機能の低下を抑制する。異なるア プローチとして、これら両方の食事の要素をMINDダイエットとして知られるものに取り入れることが行われている[214]。個々の食事成分、ミネラル、 およびサプリメントに関する研究は、ADまたは認知機能低下を予防するかどうかについては相反するものである[214]。 予後 アルツハイマー病の初期段階は診断が困難である。確定診断は通常、認知機能障害によって日常生活動作が損なわれた時点で下されるが、その人はまだ自立して 生活している場合もある。症状は、物忘れのような軽度の認知障害から、認知障害および非認知障害の段階が進むにつれて進行し、特に末期には自立した生活の 可能性がなくなる[39]。 アルツハイマー病患者の平均余命は減少する[215]。60~70歳の正常余命は23~15年であり、90歳では4.5年である[216]。アルツハイ マー病の診断後、60~70歳代前半では7~10年(13~8年の損失)、90歳代では約3年以下(1.5年の損失)である[215]。 診断後14年以上生きる人は3%未満である[217]。生存期間の短縮と有意に関連する疾患の特徴は、認知障害の重症度の増加、機能レベルの低下、神経学 的検査の障害、転倒歴、栄養不良、脱水、体重減少である。 [3]心臓疾患、糖尿病、アルコール乱用の既往歴などの他の合併症も生存期間の短縮と関連している。 218][219][220] 発症年齢が早いほど総生存年数が長くなる一方で、平均余命は健康な集団と比較した場合、若年者では特に短縮している。 男性は女性よりも生存予後が良くない[要更新][217][222]。 誤嚥性肺炎は、アルツハイマー病によってもたらされる最も頻度の高い直接的な死因である[3]。アルツハイマー病患者においてがんの有病率が低いことの背 後にある理由は依然として不明であるが、一部の研究者は、両疾患に共通する生物学的機序が関与している可能性があると仮定している。しかし、これにはさら なる調査が必要である[223]。 |
| Epidemiology See also: Alzheimer's disease in African Americans and Alzheimer's Disease in the East Asian Population Two main measures are used in epidemiological studies: incidence and prevalence. Incidence is the number of new cases per unit of person-time at risk (usually number of new cases per thousand person-years); while prevalence is the total number of cases of the disease in the population at any given time. 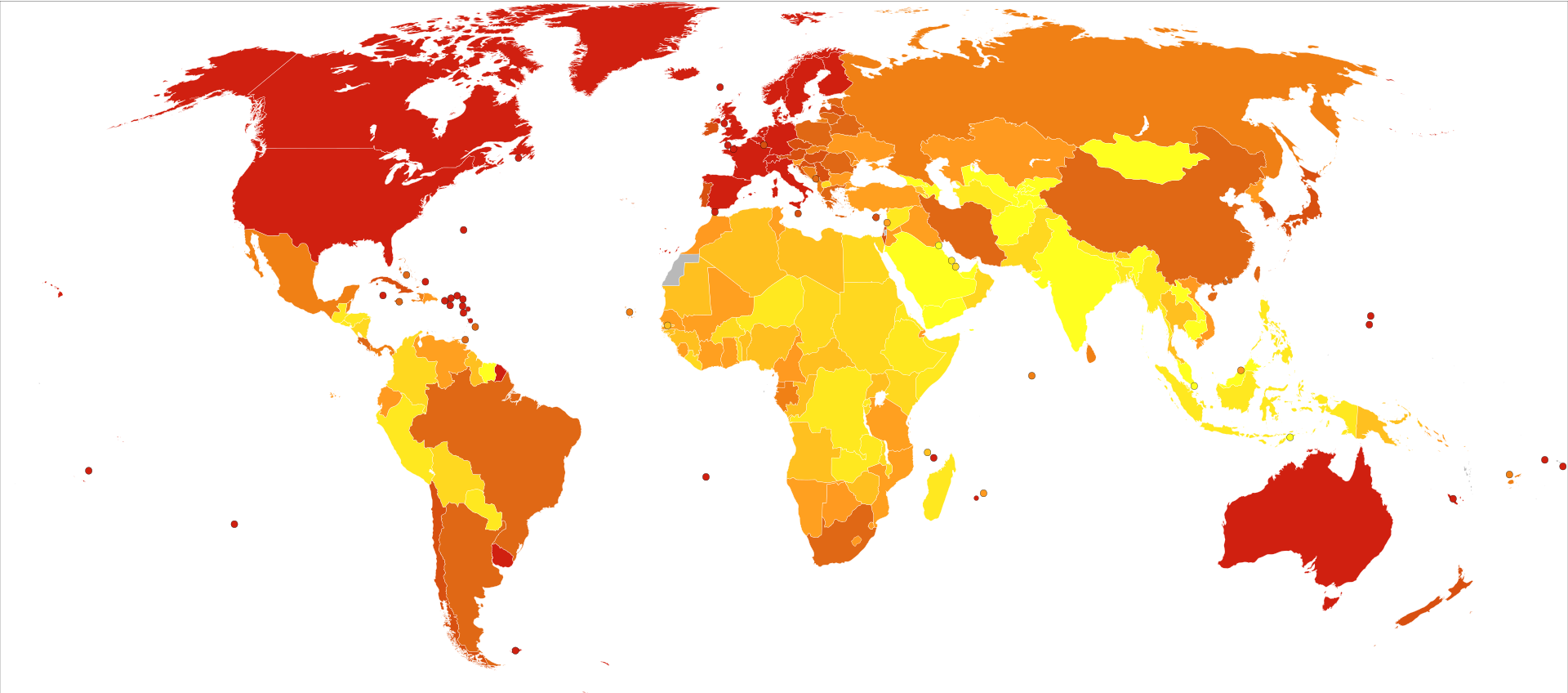 Deaths per million persons in 2012 due to dementias including Alzheimer's disease  Regarding incidence, cohort longitudinal studies (studies where a disease-free population is followed over the years) provide rates between 10 and 15 per thousand person-years for all dementias and 5–8 for Alzheimer's disease,[224][225] which means that half of new dementia cases each year are Alzheimer's disease. Advancing age is a primary risk factor for the disease and incidence rates are not equal for all ages: every 5 years after the age of 65, the risk of acquiring the disease approximately doubles, increasing from 3 to as much as 69 per thousand person years.[224][225] Females with Alzheimer's disease are more common than males, but this difference is likely due to women's longer life spans. When adjusted for age, both sexes are affected by Alzheimer's at equal rates.[15] In the United States, the risk of dying from Alzheimer's disease in 2010 was 26% higher among the non-Hispanic white population than among the non-Hispanic black population, and the Hispanic population had a 30% lower risk than the non-Hispanic white population.[226] However, much Alzheimer's research remains to be done in minority groups, such as the African American, East Asian and Hispanic/Latino populations.[227][228] Studies have shown that these groups are underrepresented in clinical trials and do not have the same risk of developing Alzheimer's when carrying certain genetic risk factors (i.e. APOE4), compared to their caucasian counterparts.[228][229][230] The prevalence of Alzheimer's disease in populations is dependent upon factors including incidence and survival. Since the incidence of Alzheimer's disease increases with age, prevalence depends on the mean age of the population for which prevalence is given. In the United States in 2020, Alzheimer's dementia prevalence was estimated to be 5.3% for those in the 60–74 age group, with the rate increasing to 13.8% in the 74–84 group and to 34.6% in those greater than 85.[231] Prevalence rates in some less developed regions around the globe are lower.[232][233] As the incidence and prevalence are steadily increasing, the prevalence itself is projected to triple by 2050.[clarification needed][234] As of 2020, 50 million people globally have AD, with this number expected to increase to 152 million by 2050.[14] |
疫学 以下も参照: アフリカ系アメリカ人のアルツハイマー病および東アジア人のアルツハイマー病 疫学研究では、主に罹患率と有病率という2つの尺度が用いられる。罹患率とは、リスクのある単位時間当たりの新規症例数(通常、1,000人年当たりの新 規症例数)であり、有病率とは、任意の時点における集団内の疾患の総症例数である。  アルツハイマー病を含む認知症による2012年の100万人当たりの死亡数  罹患率に関しては、コホート縦断研究(疾患のない集団を長年にわたって追跡する研究)により、すべての認知症について1,000人年当たり10~15人、 アルツハイマー病については5~8人の割合が示されており[224][225]、これは毎年新たに発症する認知症の半数がアルツハイマー病であることを意 味する。65歳以降、5年ごとに発症リスクは約2倍になり、1,000人年あたり3人から69人に増加する[224][225]。女性のアルツハイマー病 患者は男性よりも多いが、この差は女性の寿命が長いためと考えられる。年齢で調整すると、男女ともにアルツハイマー病に罹患する割合は等しい[15]。米 国では、2010年にアルツハイマー病で死亡するリスクは、非ヒスパニック系白人の集団では非ヒスパニック系黒人の集団よりも26%高く、ヒスパニック系 集団では非ヒスパニック系白人の集団よりも30%低かった。 [226] しかしながら、アフリカ系アメリカ人、東アジア人、ヒスパニック/ラテン系などのマイノリティ集団では、アルツハイマー病の研究がまだ多く行われていな い。 [227] [228] これらの集団は、臨床試験において十分に代表されておらず、特定の遺伝的危険因子(すなわち、APOE4)を保有している場合、白人と比較してアルツハイ マー病を発症するリスクは同じではないことが研究で示されている。 集団におけるアルツハイマー病の有病率は、罹患率および生存率を含む要因に依存する。アルツハイマー病の発生率は年齢とともに増加するため、有病率は有病 率が示された集団の平均年齢に依存する。2020年の米国では、アルツハイマー型認知症の有病率は60~74歳では5.3%、74~84歳では 13.8%、85歳以上では34.6%と推定されている[231]。 [232][233]罹患率と有病率は着実に増加しており、有病率自体は2050年までに3倍になると予測されている[要解説][234]。2020年現 在、世界で5,000万人がADであり、この数は2050年までに1億5,200万人に増加すると予測されている[14]。 |
History Alois Alzheimer's patient Auguste Deter in 1902. Hers was the first described case of what became known as Alzheimer's disease. The ancient Greek and Roman philosophers and physicians associated old age with increasing dementia.[29] It was not until 1901 that German psychiatrist Alois Alzheimer identified the first case of what became known as Alzheimer's disease, named after him, in a fifty-year-old woman he called Auguste D. He followed her case until she died in 1906 when he first reported publicly on it.[235] During the next five years, eleven similar cases were reported in the medical literature, some of them already using the term Alzheimer's disease.[29] The disease was first described as a distinctive disease by Emil Kraepelin after suppressing some of the clinical (delusions and hallucinations) and pathological features (arteriosclerotic changes) contained in the original report of Auguste D.[236] He included Alzheimer's disease, also named presenile dementia by Kraepelin, as a subtype of senile dementia in the eighth edition of his Textbook of Psychiatry, published on 15 July, 1910.[237] For most of the 20th century, the diagnosis of Alzheimer's disease was reserved for individuals between the ages of 45 and 65 who developed symptoms of dementia. The terminology changed after 1977 when a conference on Alzheimer's disease concluded that the clinical and pathological manifestations of presenile and senile dementia were almost identical, although the authors also added that this did not rule out the possibility that they had different causes.[238] This eventually led to the diagnosis of Alzheimer's disease independent of age.[239] The term senile dementia of the Alzheimer type (SDAT) was used for a time to describe the condition in those over 65, with classical Alzheimer's disease being used to describe those who were younger. Eventually, the term Alzheimer's disease was formally adopted in medical nomenclature to describe individuals of all ages with a characteristic common symptom pattern, disease course, and neuropathology.[240] The National Institute of Neurological and Communicative Disorders and Stroke (NINCDS) and the Alzheimer's Disease and Related Disorders Association (ADRDA, now known as the Alzheimer's Association) established the most commonly used NINCDS-ADRDA Alzheimer's Criteria for diagnosis in 1984,[241] extensively updated in 2007.[242][146] These criteria require that the presence of cognitive impairment, and a suspected dementia syndrome, be confirmed by neuropsychological testing for a clinical diagnosis of possible or probable Alzheimer's disease. A histopathologic confirmation including a microscopic examination of brain tissue is required for a definitive diagnosis. Good statistical reliability and validity have been shown between the diagnostic criteria and definitive histopathological confirmation.[243] |
歴史 1902年、アロイス・アルツハイマーの患者オーギュスト・デター。この患者が、アルツハイマー病として知られるようになった最初の症例である。 古代ギリシア・ローマの哲学者や医師は、老年と痴呆の増加を関連付けていた[29]。ドイツの精神科医であるアロイス・アルツハイマーが、オーギュスト・ デーテルと呼ばれる50歳の女性において、彼の名前を冠したアルツハイマー病として知られるようになった最初の症例を確認したのは1901年のことであっ た。 [1910年7月15日に出版された『精神医学の教科書』の第8版では、アルツハイマー病は老人性痴呆の亜型として、クレペリンによって先天性痴呆とも命 名された[237]。 20世紀のほとんどの間、アルツハイマー病の診断は、認知症の症状を発症した45歳から65歳までの個人にのみ与えられていた。1977年以降、アルツハ イマー病に関する会議において、老人性痴呆と先天性痴呆の臨床的および病理学的症状はほとんど同じであると結論づけられたが、著者らは、このことは両者が 異なる原因を持っている可能性を排除するものではないとも付け加えた。 [238]この結果、最終的には年齢に関係なくアルツハイマー病と診断されるようになった[239]。アルツハイマー型老人性痴呆(SDAT)という用語 は、一時期65歳以上の患者の状態を表すのに使われ、古典的アルツハイマー病はそれ以下の年齢の患者を表すのに使われた。最終的に、アルツハイマー病とい う用語は、特徴的な共通の症状パターン、疾患の経過、および神経病理学を有するすべての年齢の個人を記述するために、医学的命名法において正式に採用され た[240]。 National Institute of Neurological and Communicative Disorders and Stroke(NINCDS)とAlzheimer's Disease and Related Disorders Association(ADRDA、現在はAlzheimer's Associationとして知られている)は、1984年に診断のために最も一般的に使用されるNINCDS-ADRDA Alzheimer's Criteria(NINCDS-ADRDAアルツハイマー病診断基準)を確立し、[241]2007年に広範囲に更新された。 [242][146]これらの基準は、アルツハイマー病の可能性または可能性が高いという臨床診断のために、認知機能障害の存在、および認知症症候群の疑 いが神経心理学的検査によって確認されることを要求している。確定診断には、脳組織の顕微鏡検査を含む病理組織学的確認が必要である。診断基準と病理組織 学的確定診断との間には、良好な統計的信頼性と妥当性が示されている[243]。 |
| Society and culture See also: Alzheimer's disease organizations Social costs Dementia, and specifically Alzheimer's disease, may be among the most costly diseases for societies worldwide.[244] As populations age, these costs will probably increase and become an important social problem and economic burden.[245] Costs associated with AD include direct and indirect medical costs, which vary between countries depending on social care for a person with AD.[244][246][247] Direct costs include doctor visits, hospital care, medical treatments, nursing home care, specialized equipment, and household expenses.[244][245] Indirect costs include the cost of informal care and the loss in productivity of informal caregivers.[245] In the United States as of 2019, informal (family) care is estimated to constitute nearly three-fourths of caregiving for people with AD at a cost of US$234 billion per year and approximately 18.5 billion hours of care.[244] The cost to society worldwide to care for individuals with AD is projected to increase nearly ten-fold, and reach about US$9.1 trillion by 2050.[246] Costs for those with more severe dementia or behavioral disturbances are higher and are related to the additional caregiving time to provide physical care.[247] Caregiving burden Further information: Caregiving and dementia This section needs to be updated. Please help update this article to reflect recent events or newly available information. (February 2022) Individuals with Alzheimer's will require assistance in their lifetime, and care will most likely come in the form of a full-time caregiver which is often a role that is taken on by the spouse or a close relative. Caregiving tends to include physical and emotional burdens as well as time and financial strain at times on the person administering the aid.[248][249] Alzheimer's disease is known for placing a great burden on caregivers which includes social, psychological, physical, or economic aspects.[23][250][251] Home care is usually preferred by both those people with Alzheimer's disease as well as their families.[252] This option also delays or eliminates the need for more professional and costly levels of care.[252][253] Nevertheless, two-thirds of nursing home residents have dementias.[196] Dementia caregivers are subject to high rates of physical and mental disorders.[254] Factors associated with greater psychosocial problems of the primary caregivers include having an affected person at home, the carer being a spouse, demanding behaviors of the cared person such as depression, behavioral disturbances, hallucinations, sleep problems or walking disruptions and social isolation.[255][256] Regarding economic problems, family caregivers often give up time from work to spend 47 hours per week on average with the person with Alzheimer's disease, while the costs of caring for them are high. Direct and indirect costs of caring for somebody with Alzheimer's average between $18,000 and $77,500 per year in the United States, depending on the study.[257][249] Cognitive behavioral therapy and the teaching of coping strategies either individually or in group have demonstrated their efficacy in improving caregivers' psychological health.[23][258] Media Main article: Alzheimer's disease in the media Alzheimer's disease has been portrayed in films such as: Iris (2001), based on John Bayley's memoir of his wife Iris Murdoch;[259] The Notebook (2004), based on Nicholas Sparks's 1996 novel of the same name;[260] A Moment to Remember (2004); Thanmathra (2005);[261] Memories of Tomorrow (Ashita no Kioku) (2006), based on Hiroshi Ogiwara's novel of the same name;[262] Away from Her (2006), based on Alice Munro's short story The Bear Came over the Mountain;[263] Still Alice (2014), about a Columbia University professor who has early onset Alzheimer's disease, based on Lisa Genova's 2007 novel of the same name and featuring Julianne Moore in the title role. Documentaries on Alzheimer's disease include Malcolm and Barbara: A Love Story (1999) and Malcolm and Barbara: Love's Farewell (2007), both featuring Malcolm Pointon.[264][265][266] Alzheimer's disease has also been portrayed in music by English musician the Caretaker in releases such as Persistent Repetition of Phrases (2008), An Empty Bliss Beyond This World (2011), and Everywhere at the End of Time (2016–2019).[267][268][269] Paintings depicting the disorder include the late works by American artist William Utermohlen, who drew self-portraits from 1995 to 2000 as an experiment of showing his disease through art.[270][271] Research directions See also: Anti-amyloid drugs Antibodies may have the ability to alter the disease course by targeting amyloid beta with immunotherapy medications such as donanemab, aducanumab, and lecanemab.[272][273][274] Aducanumab was approved by the US Food and Drug Administration (FDA) in 2021 using the accelerated approval process, although the approval generated controversy and more evidence is needed to address administration, safety, and effectiveness.[275][276][277][278] It has less effectiveness in people who already had severe Alzheimer's symptoms.[279] Lecanemab was also approved via the FDA accelerated approval process,[280][281][282] and was converted to traditional approval in July 2023 after further testing, along with the addition of a black box warning about amyloid-related imaging abnormalities.[283][284] Anti-amyloid drugs also cause brain shrinkage.[285] Specific medications that may reduce the risk or progression of Alzheimer's disease have been studied.[286] The research trials investigating medications generally impact Aβ plaques, inflammation, APOE, neurotransmitter receptors, neurogenesis, growth factors or hormones.[286][287][288] Machine learning algorithms with electronic health records are being studied as a way to predict AD earlier.[289] |
社会と文化 こちらも参照: アルツハイマー病関連団体 社会的コスト 認知症、特にアルツハイマー病は、世界中の社会にとって最も費用のかかる疾患のひとつである可能性がある[244]。 高齢化が進むにつれて、これらの費用はおそらく増加し、重要な社会問題および経済的負担となる[245]。 ADに関連する費用には、直接的および間接的な医療費が含まれ、AD患者に対する社会的ケアによって国によって異なる。 [244][246][247]直接費用には、医師の診察、病院での治療、医療処置、介護施設での介護、特殊な器具、家計費などが含まれる[244] [245]。 間接費用には、インフォーマルな介護の費用やインフォーマルな介護者の生産性の損失などが含まれる[245]。 2019年時点の米国では、インフォーマル(家族)介護がAD患者の介護のほぼ4分の3を占め、年間2,340億米ドルの費用と約185億時間の介護時間 がかかると推定されている[244]。 AD患者の介護にかかる世界の社会的コストは、10倍近くに増加し、2050年までに約9兆1,000億米ドルに達すると予測されている[246]。 より重度の認知症や行動障害のある人のコストはより高く、身体的ケアを提供するための追加的な介護時間に関連している[247]。 介護負担 さらなる情報 介護と認知症 このセクションは更新が必要です。最近の出来事や新たに入手した情報を反映させるため、この記事の更新にご協力ください。(2022年2月) アルツハイマー型認知症患者は、その生涯において介助を必要とし、その介助は、配偶者や近親者が担うことが多い常勤の介護者という形で行われる可能性が高 い。介護は、身体的・精神的負担だけでなく、援助を行う人に時間的・経済的負担をかける傾向がある[248][249]。アルツハイマー病は、社会的・心 理的・身体的・経済的側面を含む大きな負担を介護者にかけることで知られている。 [23][250][251]在宅介護は通常、アルツハイマー病患者にもその家族にも好まれる[252]。 この選択肢はまた、より専門的で費用のかかるレベルの介護の必要性を遅らせたり、排除したりする[252][253]。 認知症の介護者は、高い割合で身体的および精神的な障害にさらされている[254]。 主な介護者の心理社会的な問題が大きくなる要因としては、患児が自宅にいること、介護者が配偶者であること、抑うつ、行動障害、幻覚、睡眠障害や歩行障害 などの被介護者の要求行動、社会的孤立などがある。 [255] [256] 経済的な問題については、家族介護者は、平均して週に47時間をアルツハイマー病患者のために費やすために、しばしば仕事の時間を割いている。アルツハイ マー病患者の介護にかかる直接的および間接的な費用は、研究によって異なるが、米国では年間平均18,000~77,500ドルである[257] [249]。 認知行動療法および個人またはグループでの対処戦略の指導は、介護者の心理的健康の改善に有効であることが実証されている[23][258]。 メディア 主な記事 メディアにおけるアルツハイマー病 アルツハイマー病は、以下のような映画で描かれている: ジョン・ベイリーの妻アイリス・マードックの回想録を基にした『アイリス』(2001年)、[259] ニコラス・スパークスの1996年の同名小説を基にした『ノートブック』(2004年)、[260] 『追憶のとき』(2004年)、『タンマスーラ』(2005年)、[261] 荻原浩の同名小説を基にした『明日の記憶』(2006年); [262] アリス・マンローの短編小説『The Bear Came Over the Mountain』を原作とした『Away from Her』(2006年)、[263] リサ・ジェノヴァの2007年の同名小説を原作とし、ジュリアン・ムーアがタイトルロールを演じた『Still Alice』(2014年)。アルツハイマー病に関するドキュメンタリー映画には、『マルコムとバーバラ 愛の物語』(1999年)と『マルコムとバーバラ 愛の別れ』(2007年)があり、どちらもマルコム・ポイントンが出演している[264][265][266]。 アルツハイマー病は、『Persistent Repetition of Phrases』(2008年)、『An Empty Bliss Beyond This World』(2011年)、『Everywhere at the End of Time』(2016年-2019年)などのリリースにおいて、イギリスのミュージシャンであるザ・ケアテイカーによる音楽でも描かれている[267] [268][269] 障害を描いた絵画には、1995年から2000年にかけて、芸術を通して自分の病気を見せる実験として自画像を描いたアメリカのアーティスト、ウィリア ム・ウターモーレンの晩年の作品が含まれる[270][271]。 研究の方向性 以下も参照のこと: 抗アミロイド薬 ドナネマブ、アデュカヌマブ、レカネマブなどの免疫療法薬を用いてアミロイドβを標的とすることで、抗体が疾患の経過を変える能力を有する可能性がある [272][273][274]。アデュカヌマブは、2021年に米国食品医薬品局(FDA)によって早期承認プロセスを用いて承認されたが、承認には賛 否両論があり、投与、安全性、有効性についてはさらなるエビデンスが必要である。 [275][276][277][278]すでに重篤なアルツハイマー症状を有する患者には有効性が低い。 279]レカネマブもFDAの加速承認プロセスを経て承認され[280][281][282]、アミロイド関連の画像異常に関する黒枠警告の追加ととも に、さらなる試験を経て2023年7月に従来の承認に変更された。 283][284]抗アミロイド薬も脳の縮小を引き起こす[285]。 アルツハイマー病のリスクまたは進行を抑制する可能性のある特定の薬物療法が研究されている[286]。薬物療法を研究する研究試験は、一般的にAβ斑、 炎症、APOE、神経伝達物質受容体、神経発生、成長因子またはホルモンに影響を与える[286][287][288]。 ADを早期に予測する方法として、電子カルテを用いた機械学習アルゴリズムが研究されている[289]。 |
| https://en.wikipedia.org/wiki/Alzheimer%27s_disease |
|
| 国立長寿医療研究センター「認知症の新しい治療薬アデュカヌマブについて(1)」2024年5月31日取得 アルツハイマー病は、老化に伴いアミロイドβと呼ばれるペプチド(42個のアミノ酸が鎖状につながった分子)が、脳に溜まることが原因だと考えられています(図1)。 アミロイドβは、健康な人の脳の中にも存在しますが、脳の中で分解されたり、脳の中から排出されたりするので、すぐに脳の中に溜まることはありません。し かし、老化やその他の理由で、脳の中で老廃物を処理する能力が弱まると、溜まってきたアミロイドβがお互いにくっつきあって(これを重合といいます)、ま すます分解や排出を受けにくくなります。するとそれらが次第に大きくなり、老人斑(アミロイド斑)と呼ばれる大きなかたまりを形成します(図1)。この老 人斑が、脳にたくさん溜まってくると、神経細胞が死んでしまい、脳が正常に働かなくなるために、認知症を発症すると考えられています。この考え方は、「ア ミロイド仮説」と呼ばれています。 https://www.ncgg.go.jp/ri/labo/01.html |
認知症の新しい治療薬アデュカヌマブについて(1)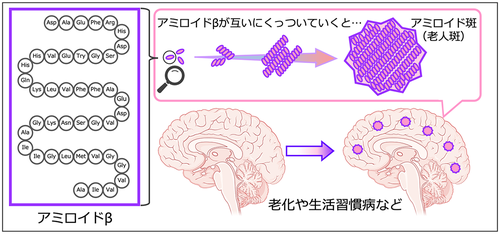 |
| アデュカヌマブはアルツハイマー病の原因に働きかける疾患修飾薬 現在使われているアルツハイマー病の薬には、患者さんの脳の中で弱った神経細胞の働きを補う薬(コリンエステラーゼ阻害薬)や、神経細胞が死んでしまうの を遅らせる薬(NMDA受容体阻害薬)があります(図2)。これらはいずれも、症状を一時的に和らげることを目的とする「対症療法」と呼ばれ、アルツハイ マー病の発症や進行を止めることはできません。 現在使われているアルツハイマー病の薬には,神経細胞の働きを補うコリンエステラーゼ阻害薬と,神経細胞の傷害を抑えるNMDA受容体阻害薬の2種類がありますが,どちらも病気の進行を止めることはできません。 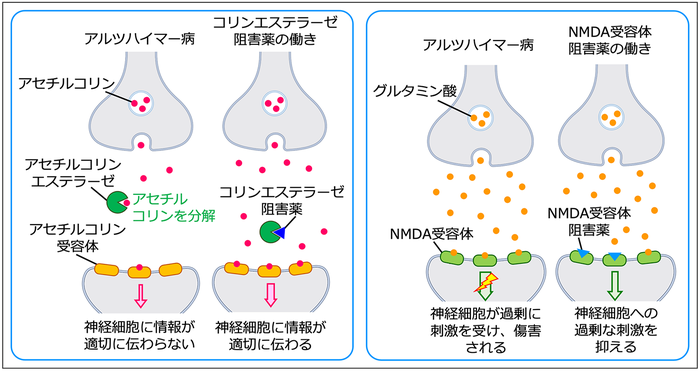 図2.現在使われているアルツハイマー病の薬は症状を緩和する作用を持つ アデュカヌマブは,アルツハイマー病の原因と考えられるアミロイド斑を脳から取り除くことを目的として開発された薬です。 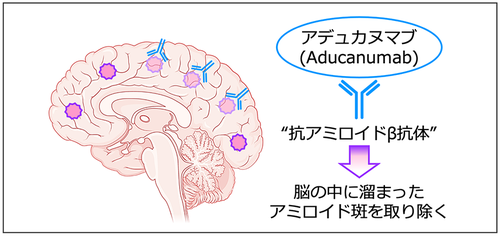 図3.アデュカヌマブはアルツハイマー病の原因を取り除く作用を持つ それに対して、アデュカヌマブはアルツハイマー病の原因と考えられる老人斑を、脳から取り除くことを目的として開発された薬です(図3)。そのため、ア デュカヌマブは、アルツハイマー病(疾患)の原因に働きかけて進行を抑える(修飾する)薬ということで、「疾患修飾薬」と呼ばれています。これは、これま でにはなかった、新しいタイプのアルツハイマー病の薬です。では、アデュカヌマブは具体的にどういう薬なのでしょうか?アデュカヌマブを英語で書くと、 Aducanumabでしたね。この最後の3文字のmabは、モノクローナル抗体(monoclonal antibody)を意味します。モノクローナル抗体とは、たんぱく質の特定のものだけを認識する抗体を意味し、その選択性の高さから様々な疾患の治療薬 として応用されています。つまりアデュカヌマブは、老人斑を認識してくっつく抗体医薬です(図3)。抗体がくっつくことで、アミロイド斑は脳の中で分解さ れやすくなると考えられています。一般的に抗体医薬は非常に高価な薬で、アデュカヌマブを使った1年間の治療には、およそ600万円かかるとも言われてい ます。 アミロイドβを標的とした抗体医薬が開発されるまで ではどのような経緯で、アミロイドβに対する抗体医薬は開発されることになったのでしょうか?今(2022年現在)から遡ること23年前の1999年、米 国の研究グループが、アミロイドβに対する抗体を体の中でつくらせることで、脳の中に溜まったアミロイドβを取り除くことができることを、動物モデルを 使った実験で証明し、世界の脳科学者に大きなインパクトを与えました(文献1)。 この発見を受けて、患者さんの体内でもアミロイドβの抗体を作らせれば、アルツハイマー病を治療できるのではないかという期待が膨らみ、ワクチン接種によ る能動免疫療法の臨床試験が開始されました。しかし、ワクチン療法を受けた数%の患者さんで、髄膜(脳を覆っている膜)に炎症が起こる重大な副作用がみら れたため、臨床試験は中止になりました。 そこで次に考えられたのが、体内で抗体を作らせる代わりに、アミロイドβに反応するモノクローナル抗体を研究室で調製してそれを体内に投与する、抗体医薬 による受動免疫療法です。これまで世界中の製薬企業が競い合って様々な種類の抗体を開発し、ヒトでも臨床試験を行ってきました。臨床試験は長らく失敗が続 きましたが、今回ニュースになったアデュカヌマブは、ようやく成功の可能性が示されたとの報告がなされました。日常診療で安心して使える薬となるには、さ らなる研究が必要ですが、アルツハイマー病に苦しむ人や家族に大きな希望を与えたことは間違いありません。アルツハイマー病の治療薬の開発には、大きな期 待が集まっています。次回は、アデュカヌマブの臨床試験について詳しくお話しします。(つづく) https://www.ncgg.go.jp/ri/labo/01.html |
リ ンク
文 献
そ の他の情報
Copyleft, CC, Mitzub'ixi Quq Chi'j, 1996-2099
☆
 ☆
☆