人工痴呆
Artifial dementia



Lithograph of a man diagnosed with dementia in the 1800s
人工痴呆
Artifial dementia



Lithograph of a man diagnosed with dementia in the 1800s
人工痴呆(artificial dementia)とは、人間の痴呆という、すばらしい思考の逸脱能力を、機械で再現することさす。しばしば、人工痴呆(の研究)は人工知能(の研究)の 反対だと言われているが、言うまでもなく、痴呆は人間にとって知識のレパートリーの一種なので、人工知能の研究は、未だ人工痴呆のレベルにまで到達してい ないというのが現状なのである。そして、エキスパートシステムに倣って、人工痴呆の研究者がぜひとも参照にしなければならない痴呆のエキスパートは言うま でもなく、人間における認知症の人であり、それを天然痴呆(natural dementia)と呼んでもいいだろう。
以下は「人
工痴呆の研究」から引用した文章であるので、そちらも適宜参照してほしい。
人 工知能(機械そのものの)の素直さに比べて人工知 能の研究者の頑迷や根性がねじ曲がった自己正当化の卑属さに閉口します。人工知 能の研究者が、どうして人工痴呆(AD)の研究をどうして始めないのか不思 議な感じがします。逆遡上技術(RE)で豊富な実験資料手に入るはずなのに。
チューリング・テストにならって、被験者が「この箱
に中に入っているやつは、バカ=痴呆か、『機械みたいなバカな奴だ』」と言った瞬間に、研究者や実験者はつかさず「そのアホさ加減とはどのような性格や行
動のことを言うのでしょう?」と問いかけるべきである。人工知能とならんで、果たして人工痴呆が作れるのか? 人工知能が「だんだん賢くなる」のであれ
ば、人工知能は「だんだんバカ」になる。痴呆症になることができるであろうか。すなわち人工痴呆は、人工知能研究と、人工知能の定義をめぐる問題のなか
で、重要な思考実験の位置を占めているのである。
私が考える、人工痴呆(AD)の研究の難しさは、人 工知能をつくりあげて、そこから痴呆にしなければならないという「偏見」がエンジニアにあるからではないか? 我々しろうとは、人工知能がアホな答えをし た時に(=チェスで打ち間違えて人間に負ける、ヒトラーまがいの反ユダヤメッセージを発するようになる、猿でもわかる臨床判断を間違う、などなど)、「そ こそこの痴呆力がついたなぁ」という発想をするけど、人工知能のエンジニアたちは、「まだまだ知力が足りないなあ」と反省するようだ。素人喜びと専門家の 悲しみは、相反する同じ軸に価値の数直線上にある。
★人工知能におけるハルシーネション
「圧倒的な性能を持つ大規模言語モデルであるが、現時点では課題もある。偽の情報を平然と出力する「hallucination(ハルシネーション、幻
覚)」と呼ばれる現象や、悪質なプロンプトを用いて、本来禁止されている機能を解除して不適切な回答を得ようとする「Prompt
Injection(プロンプトインジェクション)」の問題などが指摘されている。性能向上と並行し、こういった課題を克服するための研究も進められて
います」(→「チョムスキー言語学と自然言語処理」)
人間による人工ではない、天然痴呆の発見に、AIに よる検証が役立つのではないかという主張は次のような文言からでも明らかである。
"Researchers across the globe are developing computer programmes to spot the earliest signs of dementia. These teams are using huge amounts of data to identify changes to the physical structure of the brain in detailed scans. They are also looking for changes to the energy use and chemical make up of the brain that can’t be seen by the human eye." - How could artificial intelligence help people affected by dementia?︎

人工知能に取り組む前に、なぜ人間の愚かさを何とかしないのか?
☆人工知能と人間の能力を比べるバカから得られる他山の石
AIは人間を「超えることができない」と豪語する論
者は[その人の知性の貧困さゆえに]何をもって超える/超えないと明示しない点でAIに推論能力においては負けて[知的に劣って]いるがたぶんこのジョー
クを受容する[AIには欠けていると言われる]感性すらないのだろう.[AIには欠けていると言われる]感性つまりアパシーはAIの能力だと理解されたし
人工ASD(自閉スペクトラム症)の研究
★天然痴呆(natural dementia)→いわゆる認知症について
認知症は、多くの神経変性疾患と関連する症候群であり、認知能力の全般的な低下を特徴とし、 日常生活を営む能力に影響を及ぼす。典型的には、記憶、思考、 行動、運動制御の問題が含まれる。認知症の最も一般的な症状には、記憶障害や思考パターンの乱れの他に、感情的な問題、言語障害、意欲の低下など がある。 認知症は、最終的には本人、介護者、および社会関係全般に重大な影響を及ぼす。 認知症の診断には、その人の通常の精神機能からの変化、および通常の老化プロセスによって引き起こされるかもしれないよりも大きな認知機能の低下が観察さ れることが必要である。
| Dementia
is a syndrome associated with many neurodegenerative diseases,
characterized by a general decline in cognitive abilities that affects
a person's ability to perform everyday activities. This typically
involves problems with memory, thinking, behavior, and motor
control.[10] Aside from memory impairment and a disruption in thought
patterns, the most common symptoms of dementia include emotional
problems, difficulties with language, and decreased motivation.[2] The
symptoms may be described as occurring in a continuum over several
stages.[11][a] Dementia ultimately has a significant effect on the
individual, their caregivers, and their social relationships in
general.[2] A diagnosis of dementia requires the observation of a
change from a person's usual mental functioning and a greater cognitive
decline than might be caused by the normal aging process.[13] Several diseases and injuries to the brain, such as a stroke, can give rise to dementia. However, the most common cause is Alzheimer's disease, a neurodegenerative disorder.[2] The Diagnostic and Statistical Manual of Mental Disorders, Fifth Edition (DSM-5), has re-described dementia as a mild or major neurocognitive disorder with varying degrees of severity and many causative subtypes. The International Classification of Diseases (ICD-11) also classifies dementia as a neurocognitive disorder (NCD) with many forms or subclasses.[14] Dementia is listed as an acquired brain syndrome, marked by a decline in cognitive function, and is contrasted with neurodevelopmental disorders.[15] It is also described as a spectrum of disorders with causative subtypes of dementia based on a known disorder, such as Parkinson's disease for Parkinson's disease dementia, Huntington's disease for Huntington's disease dementia, vascular disease for vascular dementia, HIV infection causing HIV dementia, frontotemporal lobar degeneration for frontotemporal dementia, Lewy body disease for dementia with Lewy bodies, and prion diseases.[16] Subtypes of neurodegenerative dementias may also be based on the underlying pathology of misfolded proteins, such as synucleinopathies and tauopathies.[16] The coexistence of more than one type of dementia is known as mixed dementia.[15] Many neurocognitive disorders may be caused by another medical condition or disorder, including brain tumours and subdural hematoma, endocrine disorders such as hypothyroidism and hypoglycemia, nutritional deficiencies including thiamine and niacin, infections, immune disorders, liver or kidney failure, metabolic disorders such as Kufs disease, some leukodystrophies, and neurological disorders such as epilepsy and multiple sclerosis. Some of the neurocognitive deficits may sometimes show improvement with treatment of the causative medical condition.[17] Diagnosis of dementia is usually based on history of the illness and cognitive testing with imaging. Blood tests may be taken to rule out other possible causes that may be reversible, such as hypothyroidism (an underactive thyroid), and to determine the dementia subtype. One commonly used cognitive test is the mini–mental state examination. Although the greatest risk factor for developing dementia is aging, dementia is not a normal part of the aging process; many people aged 90 and above show no signs of dementia.[18] Several risk factors for dementia, such as smoking and obesity, are preventable by lifestyle changes. Screening the general older population for the disorder is not seen to affect the outcome.[19] Dementia is currently the seventh leading cause of death worldwide and has 10 million new cases reported every year (approximately one every three seconds).[2] There is no known cure for dementia. Acetylcholinesterase inhibitors such as donepezil are often used and may be beneficial in mild to moderate disorder, but the overall benefit may be minor. There are many measures that can improve the quality of life of a person with dementia and their caregivers. Cognitive and behavioral interventions may be appropriate for treating the associated symptoms of depression.[20] |
認知症は、多くの神経変性疾患と関連する症候群であり、認知能力の全般
的な低下を特徴とし、日常生活を営む能力に影響を及ぼす。典型的には、記憶、思考、行動、運動制御の問題が含まれる[10]。認知症の最も一般的な症状に
は、記憶障害や思考パターンの乱れの他に、感情的な問題、言語障害、意欲の低下などがある[2]。
[11][a]認知症は、最終的には本人、介護者、および社会関係全般に重大な影響を及ぼす[2]。
認知症の診断には、その人の通常の精神機能からの変化、および通常の老化プロセスによって引き起こされるかもしれないよりも大きな認知機能の低下が観察さ
れることが必要である[13]。 脳卒中などの脳に対するいくつかの疾患や損傷が認知症を引き起こす可能性がある。しかし、最も一般的な原因は、神経変性疾患であるアルツハイマー病である [2]。精神障害の診断と統計マニュアル第5版(DSM-5)は、認知症を軽症または重症度の異なる主要な神経認知障害として再定義しており、多くの原因 亜型がある。国際疾病分類(ICD-11)でも、認知症は多くの病型またはサブクラスを持つ神経認知障害(NCD)として分類されている。認知症は、認知 機能の低下を特徴とする後天的な脳症候群として挙げられ、神経発達障害と対比される。 [パーキンソン病認知症はパーキンソン病、ハンチントン病認知症はハンチントン病、血管性認知症は血管性疾患、HIV感染症はHIV認知症、前頭側頭葉変 性症は前頭側頭型認知症、レビー小体型認知症はレビー小体型認知症、プリオン病などである。 [神経変性認知症のサブタイプは、シヌクレオパチーやタウオパチーなど、誤って折り畳まれたタンパク質の病態に基づくこともある[16]。複数のタイプの 認知症が共存することは混合型認知症として知られている[15]。 多くの神経認知障害は、脳腫瘍や硬膜下血腫、甲状腺機能低下症や低血糖症などの内分泌障害、チアミンやナイアシンなどの栄養欠乏、感染症、免疫障害、肝不 全や腎不全、クフス病などの代謝障害、一部の白質ジストロフィー、てんかんや多発性硬化症などの神経障害など、別の医学的状態や障害によって引き起こされ ることがある。神経認知障害の一部は、原因となる医学的状態の治療により改善することがある[17]。 認知症の診断は通常、病歴と画像による認知機能検査に基づいて行われる。甲状腺機能低下症(甲状腺機能低下)などの可逆的な他の可能性のある原因を除外 し、認知症のサブタイプを決定するために、血液検査が行われることもある。一般的に用いられる認知機能検査のひとつに、ミニメンタルステート検査がある。 認知症発症の最大の危険因子は加齢であるが、認知症は加齢プロセスの正常な一部ではない。一般的な高齢者を対象に認知症のスクリーニングを行っても、その 結果に影響はないと考えられている[19]。 認知症は現在、世界第7位の死因であり、毎年1,000万件(約3秒に1件)の新しい症例が報告されている[2]。ドネペジルなどのアセチルコリンエステ ラーゼ阻害薬がしばしば使用され、軽度から中等度の障害には有益であるが、全体的な有益性はわずかである。認知症患者とその介護者のQOLを改善する方法 は数多くある。うつ病の関連症状の治療には、認知および行動介入が適切であろう [20] 。 |
| Signs and symptoms The signs and symptoms of dementia are termed as the neuropsychiatric symptoms—also known as the behavioral and psychological symptoms—of dementia.[21][22] The behavioral symptoms can include agitation, restlessness, inappropriate behavior, sexual disinhibition, and verbal or physical aggression.[23] These symptoms may result from impairments in cognitive inhibition.[24] The psychological symptoms can include depression, hallucinations (most often visual),[25] delusions, apathy, and anxiety.[23][26] The most commonly affected areas of brain function include memory, language, attention, problem solving, and visuospatial function affecting perception and orientation. The symptoms progress at a continuous rate over several stages, and they vary across the dementia subtypes.[27][11] Most types of dementia are slowly progressive with some deterioration of the brain well established before signs of the disorder become apparent. There are often other conditions present, such as high blood pressure or diabetes, and there can sometimes be as many as four of these comorbidities.[28] Signs of dementia include getting lost in a familiar neighborhood, using unusual words to refer to familiar objects, forgetting the name of a close family member or friend, forgetting old memories, and being unable to complete tasks independently.[29] People with developing dementia often fall behind on bill payments; specifically mortgage and credit cards, and a crashing credit score can be an early indicator of the disease.[30][31] People with dementia are more likely to have problems with incontinence than those of a comparable age without dementia; they are three times more likely to have urinary incontinence and four times more likely to have fecal incontinence.[32][33] |
徴候および症状 認知症の徴候および症状は、精神神経症状-認知症の行動症状および心理症状としても知られる-と呼ばれる[21][22]。行動症状には、興奮、落ち着き のなさ、不適切な行動、性的抑制の低下、言語的または身体的攻撃性が含まれる[23]。 [24] 心理学的症状には、抑うつ、幻覚(多くの場合、視覚的)、[25] 妄想、無気力、不安などがある[23][26]。最もよく影響を受ける脳機能の領域には、記憶、言語、注意、問題解決、および知覚と方向感覚に影響する視 空間機能がある。症状はいくつかの段階を経て連続的な速度で進行し、認知症のサブタイプによって異なる[27][11]。ほとんどのタイプの認知症は緩徐 に進行し、障害の徴候が明らかになる前に脳の劣化がある程度進行する。高血圧や糖尿病などの他の疾患が存在することが多く、これらの併存疾患が4つも存在 することもある[28]。 認知症の兆候としては、住み慣れた地域で道に迷う、見慣れた物を指すのにいつもと違う言葉を使う、親しい家族や友人の名前を忘れる、昔の記憶を忘れる、自 立して仕事をこなすことができなくなるなどがある[29]。認知症が進行している人は、請求書の支払いが滞ることが多く、特に住宅ローンやクレジットカー ドの支払いが滞り、クレジットスコアが暴落することがこの病気の初期の指標となることがある[30][31]。 認知症の人は、認知症でない同年齢の人に比べて失禁の問題を抱える可能性が高く、尿失禁を抱える可能性が3倍、便失禁を抱える可能性が4倍高い[32] [33]。 |
| Stages The course of dementia is often described in four stages – pre-dementia, early, middle, and late, that show a pattern of progressive cognitive and functional impairment. More detailed descriptions can be arrived at by the use of numeric scales. These scales include the Global Deterioration Scale for Assessment of Primary Degenerative Dementia (GDS or Reisberg Scale), the Functional Assessment Staging Test (FAST), and the Clinical Dementia Rating (CDR).[34] Using the GDS, which more accurately identifies each stage of the disease progression, a more detailed course is described in seven stages – two of which are broken down further into five and six degrees. Stage 7(f) is the final stage.[35][36] Pre-dementia Pre-dementia includes pre-clinical and prodromal stages. The latter stage includes mild cognitive impairment (MCI), delirium-onset, and psychiatric-onset presentations.[37] Pre-clinical Sensory dysfunction is claimed for the pre-clinical stage, which may precede the first clinical signs of dementia by up to ten years.[11] Most notably the sense of smell is lost,[11][38] associated with depression and a loss of appetite leading to poor nutrition.[39] It is suggested that this dysfunction may come about because the olfactory epithelium is exposed to the environment, and the lack of blood–brain barrier protection allows toxic elements to enter and cause damage to the chemosensory networks.[11] Prodromal Pre-dementia states considered as prodromal are mild cognitive impairment (MCI) and mild behavioral impairment (MBI).[40][41][42] Kynurenine is a metabolite of tryptophan that regulates microbiome signalling, immune cell response, and neuronal excitation. A disruption in the kynurenine pathway may be associated with the neuropsychiatric symptoms and cognitive prognosis in mild dementia.[43][44] Signs and symptoms at the prodromal stage may be subtle, and the early signs often become apparent only in hindsight.[45] Of those diagnosed with MCI, 70% later progress to dementia.[13] In MCI, changes in the person's brain have been happening for a long time, but the symptoms are just beginning to appear. These problems, however, are not severe enough to affect daily function. If and when they do, the diagnosis becomes dementia. The person may have some memory problems and trouble finding words, but they can solve everyday problems and competently handle their life affairs.[46] During this stage, it is ideal to ensure that advance care planning has occurred to protect the person's wishes. Advance directives exist that are specific to sufferers of dementia;[47] these can be particularly helpful in addressing the decisions related to feeding which come with the progression of the illness. MCI has been relisted in both DSM-5 and ICD-11 as "mild neurocognitive disorders", i.e. milder forms of the major neurocognitive disorder (dementia) subtypes.[48] Early In the early stage of dementia, symptoms become noticeable to other people. In addition, the symptoms begin to interfere with daily activities, and will register a score on a mini–mental state examination (MMSE). MMSE scores are set at 24 to 30 for a normal cognitive rating and lower scores reflect severity of symptoms. The symptoms are dependent on the type of dementia. More complicated chores and tasks around the house or at work become more difficult. The person can usually still take care of themselves but may forget things like taking pills or doing laundry and may need prompting or reminders.[49] The symptoms of early dementia usually include memory difficulty, but can also include some word-finding problems, and problems with executive functions of planning and organization.[50] Managing finances may prove difficult. Other signs might be getting lost in new places, repeating things, and personality changes.[51] In some types of dementia, such as dementia with Lewy bodies and frontotemporal dementia, personality changes and difficulty with organization and planning may be the first signs.[52] Middle As dementia progresses, initial symptoms generally worsen. The rate of decline is different for each person. MMSE scores between 6–17 signal moderate dementia. For example, people with moderate Alzheimer's dementia lose almost all new information. People with dementia may be severely impaired in solving problems, and their social judgment is often impaired. They cannot usually function outside their own home, and generally should not be left alone. They may be able to do simple chores around the house but not much else, and begin to require assistance for personal care and hygiene beyond simple reminders.[13] A lack of insight into having the condition will become evident.[53][54] Late People with late-stage dementia typically turn increasingly inward and need assistance with most or all of their personal care. People with dementia in the late stages usually need 24-hour supervision to ensure their personal safety, and meeting of basic needs. If left unsupervised, they may wander or fall; may not recognize common dangers such as a hot stove; or may not realize that they need to use the bathroom and become incontinent.[46] They may not want to get out of bed, or may need assistance doing so. Commonly, the person no longer recognizes familiar faces. They may have significant changes in sleeping habits or have trouble sleeping at all.[13] Changes in eating frequently occur. Cognitive awareness is needed for eating and swallowing and progressive cognitive decline results in eating and swallowing difficulties. This can cause food to be refused, or choked on, and help with feeding will often be required.[55] For ease of feeding, food may be liquidized into a thick purée. They may also struggle to walk, particularly among those with Alzheimer's disease.[56][57][58] In some cases, terminal lucidity, a form of paradoxical lucidity, occurs immediately before death; in this phenomenon, there is an unexpected recovery of mental clarity.[59] |
段階 認知症の経過は4つの段階-認知症前、初期、中期、後期-で表現されることが多く、認知機能障害が進行するパターンを示す。より詳細な説明は、数値尺度を 用いることで可能である。これらの尺度には、GDS(Global Deterioration Scale for Assessment of Primary Degenerative Dementia)、FAST(Functional Assessment Staging Test)、CDR(Clinical Dementia Rating)などがある[34]。疾患進行の各段階をより正確に特定するGDSを用いると、より詳細な経過が7つの段階-そのうちの2つはさらに5度と 6度に分けられる-で記述される。ステージ7(f)は最終ステージである。 認知症前症 認知症前症には、前臨床期と前駆期がある。後者の段階には、軽度認知障害(MCI)、せん妄発症、精神医学的発症が含まれる[37]。 前臨床期 前臨床期では感覚機能障害が主張され、認知症の最初の臨床的徴候に最大10年先行することがある[11]。最も顕著なのは嗅覚の喪失であり[11] [38]、うつ病や栄養不良につながる食欲不振と関連する[39]。この機能障害は、嗅覚上皮が環境に曝され、血液脳関門による保護がないために毒性要素 が侵入し、化学感覚ネットワークに損傷を与えるために生じる可能性が示唆されている[11]。 前駆期 前駆期と考えられる認知症前段階は、軽度認知障害(MCI)と軽度行動障害(MBI)である[40][41][42]。 キヌレニンはトリプトファンの代謝産物であり、マイクロバイオームのシグナル伝達、免疫細胞の反応、神経細胞の興奮を制御している。キヌレニン経路の障害 は、軽度認知症における精神神経症状や認知予後と関連している可能性がある[43][44]。 MCIと診断された人のうち、70%が後に認知症に進行する。 [13] MCIでは、脳内の変化は長い間起こっているが、症状が現れ始めたばかりである。しかし、これらの問題は日常生活に影響を及ぼすほど深刻ではない。もしそ うなれば、認知症と診断される。この段階では、本人の意思を守るために事前ケア計画を確実に行うことが理想的である。認知症患者に特化した事前指示書も存 在する[47]。これらの事前指示書は、病気の進行に伴って生じる摂食に関する意思決定に対処する上で特に役立つ。 MCIは、DSM-5とICD-11の両方で「軽度神経認知障害」、すなわち主要な神経認知障害(認知症)のサブタイプのより軽度な形態として再掲載され ている[48]。 初期 認知症の初期には、症状が他の人に目立つようになる。さらに、症状は日常生活に支障をきたし始め、MMSE(mini-mental state examination)のスコアを登録する。MMSEのスコアは、正常な認知機能の評価として24から30に設定され、より低いスコアは症状の重症度を 反映する。症状は認知症のタイプによって異なる。より複雑な家事や、家の中や職場での仕事がより困難になる。通常、自分の身の回りのことはできるが、薬を 飲んだり洗濯をしたりすることを忘れることがあり、促したり思い出させたりする必要がある。 初期の認知症の症状には通常、記憶障害が含まれるが、言葉を見つける問題や、計画や組織化といった実行機能の問題が含まれることもある[50]。その他の 徴候としては、新しい場所で迷子になる、物事を繰り返す、性格が変わるなどがある[51]。 レビー小体型認知症や前頭側頭型認知症など、いくつかのタイプの認知症では、人格変化や整理・計画困難が最初の徴候となることがある[52]。 中期 認知症が進行すると、初期症状は一般的に悪化する。減少の速度は人それぞれである。MMSEスコアが6~17の場合は中等度の認知症である。例えば、中等 度のアルツハイマー型認知症の人は、ほとんどすべての新しい情報を失う。認知症の人は、問題を解決することが著しく損なわれ、社会的判断がしばしば損なわ れる。通常、自分の家の外では機能できず、一般的に一人にしてはならない。家の周りの簡単な家事はできるが、それ以外はあまりできず、身の回りの世話や衛 生のために、簡単な注意を促す以上の援助を必要とし始める[13]。このような状態にあることに対する洞察力の欠如が明らかになる[53][54]。 後期 後期認知症の人は、一般的にますます内向的になり、身の回りの世話のほとんどまたはすべてについて援助を必要とするようになる。後期の認知症患者は、通 常、身の安全を確保し、基本的なニーズを満たすために24時間の監視が必要である。監督されずに放置されると、徘徊したり転倒したりすることがある。熱い ストーブなどの一般的な危険を認識できなかったり、トイレに行きたいことに気づかず失禁したりすることもある。一般的に、見知った顔を認識できなくなる。 睡眠習慣が大きく変化したり、まったく眠れなくなったりすることがある。 食事の変化は頻繁に起こる。食事や嚥下には認知的認識が必要であり、認知機能の低下が進行すると食事や嚥下が困難になる。このため、食事を拒否したり、の どに詰まらせたりすることがあり、しばしば摂食の介助が必要となる[55]。また、特にアルツハイマー病の患者では、歩行に苦労することもある[56] [57][58]。場合によっては、死の直前に逆説的明晰性の一形態である終末明晰性が生じる。 |
| Causes Many causes of dementia are neurodegenerative, and protein misfolding is a cardinal feature of these.[60] Other common causes include vascular dementia, dementia with Lewy bodies, frontotemporal dementia, and mixed dementia (commonly Alzheimer's disease and vascular dementia).[2][b][64] Less common causes include normal pressure hydrocephalus, Parkinson's disease dementia, syphilis, HIV, and Creutzfeldt–Jakob disease.[65] Alzheimer's disease Main article: Alzheimer's disease 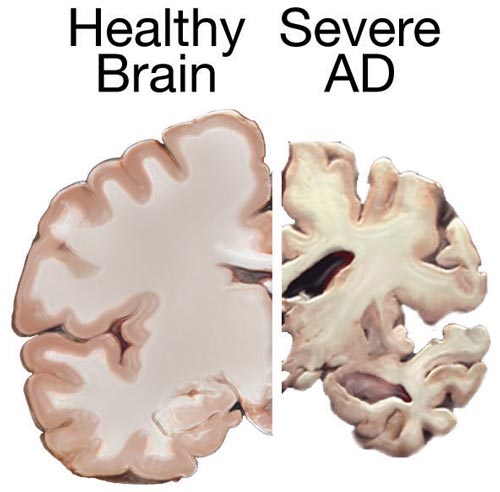 Brain atrophy in severe Alzheimer's Alzheimer's disease accounts for 60–70% of cases of dementia worldwide. The most common symptoms of Alzheimer's disease are short-term memory loss and word-finding difficulties. Trouble with visuospatial functioning (getting lost often), reasoning, judgment and insight fail. Insight refers to whether or not the person realizes they have memory problems. The part of the brain most affected by Alzheimer's is the hippocampus. Other parts that show atrophy (shrinking) include the temporal and parietal lobes. Although this pattern of brain shrinkage suggests Alzheimer's, it is variable and a brain scan is insufficient for a diagnosis. Little is known about the events that occur during and that actually cause Alzheimer's disease. This is due to the fact that brain tissue from patients with the disease can only be studied after the person's death. However, it is known that one of the first aspects of the disease is a dysfunction in the gene that produces amyloid. Extracellular senile plaques (SPs), consisting of beta-amyloid (Aβ) peptides, and intracellular neurofibrillary tangles (NFTs) that are formed by hyperphosphorylated tau proteins, are two well-established pathological hallmarks of AD.[66] Amyloid causes inflammation around the senile plaques of the brain, and too much build-up of this inflammation leads to changes in the brain that cannot be controlled, leading to the symptoms of Alzheimer's.[67] Several articles have been published on a possible relationship (as an either primary cause or exacerbation of Alzheimer's disease) between general anesthesia and Alzheimer's in specifically the elderly.[68] Vascular Main article: Vascular dementia Vascular dementia accounts for at least 20% of dementia cases, making it the second most common type.[69] It is caused by disease or injury affecting the blood supply to the brain, typically involving a series of mini-strokes. The symptoms of this dementia depend on where in the brain the strokes occurred and whether the blood vessels affected were large or small.[13] Repeated injury can cause progressive dementia over time, while a single injury located in an area critical for cognition such as the hippocampus, or thalamus, can lead to sudden cognitive decline.[69] Elements of vascular dementia may be present in all other forms of dementia.[70] Brain scans may show evidence of multiple strokes of different sizes in various locations. People with vascular dementia tend to have risk factors for disease of the blood vessels, such as tobacco use, high blood pressure, atrial fibrillation, high cholesterol, diabetes, or other signs of vascular disease such as a previous heart attack or angina.[71] Lewy bodies Main article: Dementia with Lewy bodies The prodromal symptoms of dementia with Lewy bodies (DLB) include mild cognitive impairment, and delirium onset.[72] The symptoms of DLB are more frequent, more severe, and earlier presenting than in the other dementia subtypes.[73] Dementia with Lewy bodies has the primary symptoms of fluctuating cognition, alertness or attention; REM sleep behavior disorder (RBD); one or more of the main features of parkinsonism, not due to medication or stroke; and repeated visual hallucinations.[74] The visual hallucinations in DLB are generally vivid hallucinations of people or animals and they often occur when someone is about to fall asleep or wake up. Other prominent symptoms include problems with planning (executive function) and difficulty with visual-spatial function,[13] and disruption in autonomic bodily functions.[75] Abnormal sleep behaviors may begin before cognitive decline is observed and are a core feature of DLB.[74] RBD is diagnosed either by sleep study recording or, when sleep studies cannot be performed, by medical history and validated questionnaires.[74] Parkinson's disease Parkinson's disease is associated with Lewy body dementia that often progresses to Parkinson's disease dementia following a period of dementia-free Parkinson's disease.[76] Frontotemporal Main article: Frontotemporal dementia Frontotemporal dementias (FTDs) are characterized by drastic personality changes and language difficulties. In all FTDs, the person has a relatively early social withdrawal and early lack of insight. Memory problems are not a main feature.[13][77] There are six main types of FTD. The first has major symptoms in personality and behavior. This is called behavioral variant FTD (bv-FTD) and is the most common. The hallmark feature of bv-FTD is impulsive behavior, and this can be detected in pre-dementia states.[42] In bv-FTD, the person shows a change in personal hygiene, becomes rigid in their thinking, and rarely acknowledges problems; they are socially withdrawn, and often have a drastic increase in appetite. They may become socially inappropriate. For example, they may make inappropriate sexual comments, or may begin using pornography openly. One of the most common signs is apathy, or not caring about anything. Apathy, however, is a common symptom in many dementias.[13] Two types of FTD feature aphasia (language problems) as the main symptom. One type is called semantic variant primary progressive aphasia (SV-PPA). The main feature of this is the loss of the meaning of words. It may begin with difficulty naming things. The person eventually may lose the meaning of objects as well. For example, a drawing of a bird, dog, and an airplane in someone with FTD may all appear almost the same.[13] In a classic test for this, a patient is shown a picture of a pyramid and below it a picture of both a palm tree and a pine tree. The person is asked to say which one goes best with the pyramid. In SV-PPA the person cannot answer that question. The other type is called non-fluent agrammatic variant primary progressive aphasia (NFA-PPA). This is mainly a problem with producing speech. They have trouble finding the right words, but mostly they have a difficulty coordinating the muscles they need to speak. Eventually, someone with NFA-PPA only uses one-syllable words or may become totally mute. A frontotemporal dementia associated with amyotrophic lateral sclerosis (ALS) known as (FTD-ALS) includes the symptoms of FTD (behavior, language and movement problems) co-occurring with amyotrophic lateral sclerosis (loss of motor neurons). Two FTD-related disorders are progressive supranuclear palsy (also classed as a Parkinson-plus syndrome),[78][79] and corticobasal degeneration.[13] These disorders are tau-associated. Huntington's disease Main article: Huntington's disease Huntington's disease is a neurodegenerative disease caused by mutations in a single gene HTT, that encodes for huntingtin protein. Symptoms include cognitive impairment and this usually declines further into dementia.[80] The first main symptoms of Huntington's disease often include: difficulty concentrating memory lapses depression - this can include low mood, lack of interest in things, or just abnormal feelings of hopelessness stumbling and clumsiness that is out of the ordinary mood swings, such as irritability or aggressive behavior to insignificant things[81] HIV Main article: HIV-associated neurocognitive disorder HIV-associated dementia results as a late stage from HIV infection, and mostly affects younger people.[82] The essential features of HIV-associated dementia are disabling cognitive impairment accompanied by motor dysfunction, speech problems and behavioral change.[82] Cognitive impairment is characterised by mental slowness, trouble with memory and poor concentration. Motor symptoms include a loss of fine motor control leading to clumsiness, poor balance and tremors. Behavioral changes may include apathy, lethargy and diminished emotional responses and spontaneity. Histopathologically, it is identified by the infiltration of monocytes and macrophages into the central nervous system (CNS), gliosis, pallor of myelin sheaths, abnormalities of dendritic processes and neuronal loss.[83] Creutzfeldt–Jakob disease Main article: Creutzfeldt–Jakob disease Creutzfeldt–Jakob disease is a rapidly progressive prion disease that typically causes dementia that worsens over weeks to months. Prions are disease-causing pathogens created from abnormal proteins.[84] Alcoholism Main article: Alcohol-related dementia Alcohol-related dementia, also called alcohol-related brain damage, occurs as a result of excessive use of alcohol particularly as a substance abuse disorder. Different factors can be involved in this development including thiamine deficiency and age vulnerability.[85][86] A degree of brain damage is seen in more than 70% of those with alcohol use disorder. Brain regions affected are similar to those that are affected by aging, and also by Alzheimer's disease. Regions showing loss of volume include the frontal, temporal, and parietal lobes, as well as the cerebellum, thalamus, and hippocampus.[86] This loss can be more notable, with greater cognitive impairments seen in those aged 65 years and older.[86] Mixed dementia More than one type of dementia, known as mixed dementia, may exist together in about 10% of dementia cases.[2] The most common type of mixed dementia is Alzheimer's disease and vascular dementia.[87] This particular type of mixed dementia's main onsets are a mixture of old age, high blood pressure, and damage to blood vessels in the brain.[15] Diagnosis of mixed dementia can be difficult, as often only one type will predominate. This makes the treatment of people with mixed dementia uncommon, with many people missing out on potentially helpful treatments. Mixed dementia can mean that symptoms onset earlier, and worsen more quickly since more parts of the brain will be affected.[15] Other Chronic inflammatory conditions that may affect the brain and cognition include Behçet's disease, multiple sclerosis, sarcoidosis, Sjögren's syndrome, lupus, celiac disease, and non-celiac gluten sensitivity.[88][89] These types of dementias can rapidly progress, but usually have a good response to early treatment. This consists of immunomodulators or steroid administration, or in certain cases, the elimination of the causative agent.[89] A 2019 review found no association between celiac disease and dementia overall but a potential association with vascular dementia.[90] A 2018 review found a link between celiac disease or non-celiac gluten sensitivity and cognitive impairment and that celiac disease may be associated with Alzheimer's disease, vascular dementia, and frontotemporal dementia.[91] A strict gluten-free diet started early may protect against dementia associated with gluten-related disorders.[90][91] Cases of easily reversible dementia include hypothyroidism, vitamin B12 deficiency, Lyme disease, and neurosyphilis. For Lyme disease and neurosyphilis, testing should be done if risk factors are present. Because risk factors are often difficult to determine, testing for neurosyphilis and Lyme disease, as well as other mentioned factors, may be undertaken as a matter of course where dementia is suspected.[13]: 31–32 Many other medical and neurological conditions include dementia only late in the illness. For example, a proportion of patients with Parkinson's disease develop dementia, though widely varying figures are quoted for this proportion.[92] When dementia occurs in Parkinson's disease, the underlying cause may be dementia with Lewy bodies or Alzheimer's disease, or both.[93] Cognitive impairment also occurs in the Parkinson-plus syndromes of progressive supranuclear palsy and corticobasal degeneration (and the same underlying pathology may cause the clinical syndromes of frontotemporal lobar degeneration). Although the acute porphyrias may cause episodes of confusion and psychiatric disturbance, dementia is a rare feature of these rare diseases. Limbic-predominant age-related TDP-43 encephalopathy (LATE) is a type of dementia that primarily affects people in their 80s or 90s and in which TDP-43 protein deposits in the limbic portion of the brain.[94] Hereditary disorders that can also cause dementia include: some metabolic disorders such as lysosomal storage disorders, leukodystrophies, and spinocerebellar ataxias. Persistent loneliness may significantly increase the risk of dementia according to a 2024 new study published in Nature Mental Health.[95] Researchers found that loneliness was associated with a 31% higher likelihood of developing any form of dementia, and it also raised the risk of cognitive impairment by 15%.[96] |
原因 認知症の原因の多くは神経変性であり、タンパク質のミスフォールディングはこれらの主要な特徴である[60]。その他の一般的な原因には、血管性認知症、 レビー小体型認知症、前頭側頭型認知症、混合型認知症(一般にアルツハイマー病と血管性認知症)がある[2][b][64]。一般的でない原因には、正常 圧水頭症、パーキンソン病認知症、梅毒、HIV、クロイツフェルト・ヤコブ病がある[65]。 アルツハイマー病 主な記事 アルツハイマー病  重度のアルツハイマー病における脳の萎縮 アルツハイマー病は、世界の認知症の60~70%を占める。アルツハイマー病の最も一般的な症状は、短期的な記憶喪失と言葉を見つけることの困難さであ る。視空間機能障害(よく道に迷う)、推論、判断、洞察ができなくなる。洞察力とは、記憶障害を自覚するか否かを指す。 アルツハイマー病によって最も影響を受ける脳の部位は海馬である。萎縮(縮小)を示す他の部分には、側頭葉と頭頂葉が含まれる。このような脳の縮小パター ンはアルツハイマー病を示唆しているが、そのパターンは様々であり、脳スキャンだけでは診断には不十分である。 アルツハイマー病の進行中に起こる現象や、実際にアルツハイマー病を引き起こす原因についてはほとんどわかっていない。これは、アルツハイマー病患者の脳 組織は死後しか研究できないという事実によるものである。しかし、この病気の最初の側面の一つは、アミロイドを産生する遺伝子の機能障害であることが知ら れている。β-アミロイド(Aβ)ペプチドからなる細胞外の老人斑(SP)と、リン酸化が進んだタウ蛋白質によって形成される細胞内の神経原線維変化 (NFT)は、ADの病理学的特徴として確立されている2つである[66]。アミロイドは脳の老人斑の周囲に炎症を引き起こし、この炎症が蓄積しすぎる と、コントロールできない脳の変化を引き起こし、アルツハイマー病の症状を引き起こす[67]。 特に高齢者における全身麻酔とアルツハイマー病との間の可能性のある関係(アルツハイマー病の主原因または増悪のいずれかとして)に関する論文がいくつか 発表されている[68]。 血管 主な記事 血管性痴呆 血管性認知症は認知症患者の少なくとも20%を占め、2番目に多いタイプである[69]。脳への血液供給に影響を及ぼす疾患または損傷によって引き起こさ れ、典型的には一連の小梗塞を伴う。この認知症の症状は、脳卒中が脳のどこで起こったか、影響を受けた血管が太いか細いかによって異なる[13]。損傷を 繰り返すと、時間の経過とともに認知症が進行するが、海馬や視床のような認知に重要な部位に1回損傷を受けると、突然認知機能が低下する[69]。 脳スキャンでは、様々な場所に大きさの異なる複数の脳卒中の証拠を示すことがある。血管性痴呆の患者は、タバコの使用、高血圧、心房細動、高コレステロー ル、糖尿病、または心臓発作や狭心症の既往などの血管疾患の徴候など、血管疾患の危険因子を有する傾向がある[71]。 レビー小体 主な記事 レビー小体型認知症 レビー小体型認知症(DLB)の前駆症状には、軽度認知障害、せん妄が含まれる[72]。DLBの症状は、他の認知症亜型よりも頻度が高く、重症で、早期 に発現する。 [73] レビー小体型認知症は、認知、注意力または注意力の変動、レム睡眠行動障害(RBD)、薬物療法や脳卒中によるものではないパーキンソニズムの主な特徴の 1つ以上、および繰り返される幻視を主症状とする[74]。その他の顕著な症状には、計画(実行機能)の問題や視覚-空間機能の障害[13]、自律神経身 体機能の障害などがある[75]。異常な睡眠行動は、認知機能の低下が認められる前に始まることがあり、DLBの中核的な特徴である[74]。RBDは、 睡眠検査の記録、または睡眠検査が実施できない場合は病歴聴取と有効な質問票によって診断される[74]。 パーキンソン病 パーキンソン病はレビー小体型認知症を伴い、認知症を伴わないパーキンソン病の後にパーキンソン病認知症に進行することが多い[76]。 前頭側頭型 主な記事 前頭側頭型認知症 前頭側頭型認知症(FTD)は、急激な人格変化と言語障害を特徴とする。すべてのFTDにおいて、比較的早期に社会的引きこもりと早期の洞察力の欠如がみ られる。記憶障害は主な特徴ではない[13][77]。FTDには6つの主なタイプがある。最初のものは、性格と行動に主な症状がある。これは行動変型 FTD(bv-FTD)と呼ばれ、最も一般的である。bv-FTDの特徴的な特徴は衝動的な行動であり、これは認知症になる前の状態でも検出される [42]。社会的に不適切になることもある。例えば、不適切な性的発言をしたり、ポルノグラフィーを公然と利用し始めたりする。最も一般的な徴候のひとつ は、無気力、つまり何も気にかけないことである。しかし、無気力は多くの認知症に共通する症状である [13] 。 FTDには、失語症(言語障害)を主症状とする2つのタイプがある。そのひとつは、意味変異型原発性進行性失語症(SV-PPA)と呼ばれるものである。 この主な特徴は、言葉の意味が分からなくなることである。物事の名前を挙げることが困難になることから始まる。やがて物の意味もわからなくなる。例えば、 FTDの人の鳥、犬、飛行機の絵は、どれもほとんど同じに見えるかもしれない[13]。この典型的なテストでは、患者にピラミッドの絵を見せ、その下にヤ シの木と松の木の絵を見せる。患者は、どちらがピラミッドに最もよく似合うかを答えるよう求められる。SV-PPAではその質問に答えることができない。 もう一つのタイプは、非流暢性失語変型一次進行性失語(NFA-PPA)と呼ばれるものである。これは主に発話に問題がある。適切な言葉を見つけるのが難 しいが、ほとんどの場合、話すために必要な筋肉の調整が難しい。最終的に、NFA-PPAの患者は一音節の単語しか使えなくなるか、完全に無言になる。 FTD-ALSとして知られる筋萎縮性側索硬化症(ALS)に伴う前頭側頭型認知症は、筋萎縮性側索硬化症(運動ニューロンの喪失)にFTDの症状(行 動、言語、動作の問題)が併発したものである。FTDに関連する2つの疾患は、進行性核上性麻痺(パーキンソンプラス症候群としても分類される)、 [78][79]および皮質基底変性症である。 ハンチントン病 主な記事 ハンチントン病 ハンチントン病は、ハンチンチンタンパク質をコードする単一の遺伝子HTTの変異によって引き起こされる神経変性疾患である。症状には認知機能障害が含ま れ、通常、認知症へと進行する[80]。 ハンチントン病の最初の主な症状には以下のようなものがある: 集中困難 記憶障害 抑うつ-気分の落ち込み、物事への興味の欠如、または単に絶望的な異常な感情を含むことがある。 普段とは違うつまずきや不器用さ 些細なことに対する過敏性や攻撃的な行動などの気分の変動[81]。 HIV感染症 主な記事 HIV関連神経認知障害 HIV関連認知症の本質的な特徴は、運動機能障害、言語障害および行動変容を伴う、障害のある認知障害である[82]。認知障害は、精神的な遅さ、記憶障 害および集中力の低下を特徴とする。運動症状には、不器用さ、平衡感覚の低下、振戦につながる細かい運動制御の喪失が含まれる。行動の変化としては、無気 力、無気力、感情的反応や自発性の低下がある。病理組織学的には、中枢神経系(CNS)への単球およびマクロファージの浸潤、グリオーシス、ミエリン鞘の 蒼白化、樹状突起の異常および神経細胞の喪失によって同定される[83]。 クロイツフェルト・ヤコブ病 主な記事 クロイツフェルト・ヤコブ病 クロイツフェルト・ヤコブ病は急速に進行するプリオン病であり、通常、数週間から数ヵ月にわたって認知症が悪化する。プリオンは、異常なタンパク質から作 られる病気を引き起こす病原体である[84]。 アルコール依存症 主な記事 アルコール関連認知症 アルコール関連認知症は、アルコール関連脳障害とも呼ばれ、特に薬物乱用障害としてのアルコールの過剰使用の結果として起こる。この発症には、チアミン欠 乏や加齢による脆弱性など、さまざまな要因が関与している可能性がある[85][86]。アルコール使用障害のある人の70%以上に、ある程度の脳損傷が みられる。影響を受ける脳の部位は、加齢やアルツハイマー病によって影響を受ける部位と類似している。容積の減少を示す領域には、前頭葉、側頭葉、頭頂 葉、および小脳、視床、海馬が含まれる[86]。この減少はより顕著であり、65歳以上ではより大きな認知障害が認められる[86]。 混合型認知症 混合型認知症として知られる複数のタイプの認知症は、認知症症例の約10%において共に存在する可能性がある[2]。混合型認知症の最も一般的なタイプ は、アルツハイマー病と血管性認知症である[87]。 この特定のタイプの混合型認知症の主な発症は、老齢、高血圧、脳の血管の損傷の混合である[15]。 混合型認知症の診断は、しばしば1つのタイプのみが優勢であるため、困難である。そのため、混合型認知症の人の治療はまれであり、多くの人が有用な治療法 を受けられないでいる。混合型認知症は、脳のより多くの部分が影響を受けるため、症状がより早く発症し、より早く悪化する可能性がある[15]。 その他 脳と認知に影響を及ぼす可能性のある慢性炎症性疾患には、ベーチェット病、多発性硬化症、サルコイドーシス、シェーグレン症候群、ループス、セリアック 病、非セリアックグルテン過敏症などがある[88][89]。2019年のレビューでは、セリアック病と認知症全体との関連は認められなかったが、血管性 認知症との潜在的な関連は認められた。 [90]2018年のレビューでは、セリアック病または非セリアック性グルテン過敏症と認知機能障害との間に関連性があり、セリアック病がアルツハイマー 病、血管性認知症、前頭側頭型認知症と関連する可能性があることが判明した[91]。早期から厳格なグルテン除去食を開始することで、グルテン関連疾患に 関連する認知症から保護される可能性がある[90][91]。 容易に可逆的な認知症には、甲状腺機能低下症、ビタミンB12欠乏症、ライム病、神経梅毒などがある。ライム病と神経梅毒については、危険因子が存在する 場合は検査を行うべきである。危険因子の特定はしばしば困難であるため、認知症が疑われる場合には、神経梅毒とライム病、およびその他の言及された因子の 検査を当然のこととして行うことができる[13]: 31-32 他の多くの医学的、神経学的疾患では、認知症は病気の後半になってから発症する。例えば、パーキンソン病患者の一部は認知症を発症するが、その割合につい ては様々な数字が引用されている[92]。パーキンソン病で認知症が発症する場合、根本的な原因はレビー小体型認知症またはアルツハイマー病、あるいはそ の両方である可能性がある[93]。 認知機能障害は、パーキンソン病+α症候群である進行性核上性麻痺および皮質基底変性症でも発症する(同じ病理が前頭側頭葉変性症の臨床症候群を引き起こ す可能性もある)。急性ポルフィリア症は錯乱や精神障害のエピソードを引き起こすことがあるが、痴呆はこれらのまれな疾患のまれな特徴である。辺縁優位型 加齢性TDP-43脳症(LATE)は、主に80~90歳代の人が罹患する認知症の一種であり、TDP-43タンパク質が脳の辺縁部に沈着する[94]。 認知症の原因となる遺伝性疾患には、ライソゾーム貯蔵障害、白質ジストロフィー、脊髄小脳失調症などの代謝障害がある。 Nature Mental Health』誌に発表された2024年の新しい研究によると、持続的な孤独は認知症のリスクを有意に増加させる可能性がある[95]。研究者らは、孤独 はあらゆる形態の認知症を発症する可能性を31%高めることと関連し、認知機能障害のリスクも15%高めることを発見した[96]。 |
| Diagnosis Symptoms are similar across dementia types and it is difficult to diagnose by symptoms alone. Diagnosis may be aided by brain scanning techniques. In many cases, the diagnosis requires a brain biopsy to become final, but this is rarely recommended (though it can be performed at autopsy). In those who are getting older, general screening for cognitive impairment using cognitive testing or early diagnosis of dementia has not been shown to improve outcomes.[19][97] However, screening exams are useful in 65+ persons with memory complaints.[13] Normally, symptoms must be present for at least six months to support a diagnosis.[98] Cognitive dysfunction of shorter duration is called delirium. Delirium can be easily confused with dementia due to similar symptoms. Delirium is characterized by a sudden onset, fluctuating course, a short duration (often lasting from hours to weeks), and is primarily related to a somatic (or medical) disturbance. In comparison, dementia has typically a long, slow onset (except in the cases of a stroke or trauma), slow decline of mental functioning, as well as a longer trajectory (from months to years).[99] Some mental illnesses, including depression and psychosis, may produce symptoms that must be differentiated from both delirium and dementia.[100] These are differently diagnosed as pseudodementias, and any dementia evaluation needs to include a depression screening such as the Neuropsychiatric Inventory or the Geriatric Depression Scale.[101][13] Physicians used to think that people with memory complaints had depression and not dementia (because they thought that those with dementia are generally unaware of their memory problems). However, researchers have realized that many older people with memory complaints in fact have mild cognitive impairment the earliest stage of dementia. Depression should always remain high on the list of possibilities, however, for an elderly person with memory trouble. Changes in thinking, hearing and vision are associated with normal ageing and can cause problems when diagnosing dementia due to the similarities.[102] Given the challenging nature of predicting the onset of dementia and making a dementia diagnosis clinical decision making aids underpinned by machine learning and artificial intelligence have the potential to enhance clinical practice.[103] Cognitive testing See also: Cognitive inhibition and Executive dysfunction § Testing and measurement 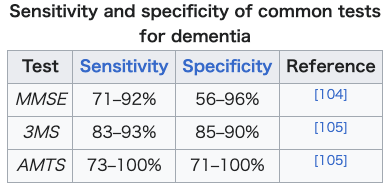 Various brief cognitive tests (5–15 minutes) have reasonable reliability to screen for dementia, but may be affected by factors such as age, education and ethnicity.[106] Age and education have a significant influence on the diagnosis of dementia. For example, Individuals with lower education are more likely to be diagnosed with dementia than their educated counterparts.[107] While many tests have been studied,[108][109][110] presently the mini mental state examination (MMSE) is the best studied and most commonly used. The MMSE is a useful tool for helping to diagnose dementia if the results are interpreted along with an assessment of a person's personality, their ability to perform activities of daily living, and their behaviour.[4] Other cognitive tests include the abbreviated mental test score (AMTS), the, "modified mini–mental state examination" (3MS),[111] the Cognitive Abilities Screening Instrument (CASI),[112] the Trail-making test,[113] and the clock drawing test.[34] The MoCA (Montreal Cognitive Assessment) is a reliable screening test and is available online for free in 35 different languages.[13] The MoCA has also been shown somewhat better at detecting mild cognitive impairment than the MMSE.[114][41] People with hearing loss, which commonly occurs alongside dementia, score worse in the MoCA test, which could lead to a false diagnosis of dementia. Researchers have developed an adapted version of the MoCA test, which is accurate and reliable and avoids the need for people to listen and respond to questions.[115][116] The AD-8 – a screening questionnaire used to assess changes in function related to cognitive decline – is potentially useful, but is not diagnostic, is variable, and has risk of bias.[117] An integrated cognitive assessment (CognICA) is a five-minute test that is highly sensitive to the early stages of dementia, and uses an application deliverable to an iPad.[118][119] Previously in use in the UK, in 2021 CognICA was given FDA approval for its commercial use as a medical device.[119] Another approach to screening for dementia is to ask an informant (relative or other supporter) to fill out a questionnaire about the person's everyday cognitive functioning. Informant questionnaires provide complementary information to brief cognitive tests. Probably the best known questionnaire of this sort is the Informant Questionnaire on Cognitive Decline in the Elderly (IQCODE).[120] Evidence is insufficient to determine how accurate the IQCODE is for diagnosing or predicting dementia.[121] The Alzheimer's Disease Caregiver Questionnaire is another tool. It is about 90% accurate for Alzheimer's when by a caregiver.[13] The General Practitioner Assessment Of Cognition combines both a patient assessment and an informant interview. It was specifically designed for use in the primary care setting. Clinical neuropsychologists provide diagnostic consultation following administration of a full battery of cognitive testing, often lasting several hours, to determine functional patterns of decline associated with varying types of dementia. Tests of memory, executive function, processing speed, attention and language skills are relevant, as well as tests of emotional and psychological adjustment. These tests assist with ruling out other etiologies and determining relative cognitive decline over time or from estimates of prior cognitive abilities.[122] Laboratory tests Routine blood tests are usually performed to rule out treatable causes. These include tests for vitamin B12, folic acid, thyroid-stimulating hormone (TSH), C-reactive protein, full blood count, electrolytes, calcium, renal function, and liver enzymes. Abnormalities may suggest vitamin deficiency, infection, or other problems that commonly cause confusion or disorientation in the elderly.[123] Imaging A CT scan or MRI scan is commonly performed to possibly find either normal pressure hydrocephalus, a potentially reversible cause of dementia, or connected tumor. The scans can also yield information relevant to other types of dementia, such as infarction (stroke) that would point at a vascular type of dementia. These tests do not pick up diffuse metabolic changes associated with dementia in a person who shows no gross neurological problems (such as paralysis or weakness) on a neurological exam.[124] The functional neuroimaging modalities of SPECT and PET are more useful in assessing long-standing cognitive dysfunction, since they have shown similar ability to diagnose dementia as a clinical exam and cognitive testing.[125] The ability of SPECT to differentiate vascular dementia from Alzheimer's disease, appears superior to differentiation by clinical exam.[126] The value of PiB-PET imaging using Pittsburgh compound B (PiB) as a radiotracer has been established in predictive diagnosis, particularly Alzheimer's disease.[127] |
診断 症状は認知症の種類によって類似しており、症状だけで診断することは困難である。診断は脳スキャン技術によって助けられるかもしれない。多くの場合、診断 を確定するためには脳生検が必要であるが、これが推奨されることは稀である(ただし、剖検時に実施されることはある)。高齢者では、認知機能検査を用いた 認知機能障害の一般的なスクリーニングや認知症の早期診断が予後を改善することは示されていない[19][97]が、65歳以上の記憶障害を訴える人には スクリーニング検査が有用である[13]。 通常、診断の根拠となる症状は少なくとも6ヵ月間存在しなければならない[98]。せん妄は、症状が似ているために認知症と混同されやすい。せん妄は、突 然発症し、経過が変動し、持続時間が短く(多くの場合、数時間から数週間)、主に身体的(または医学的)障害に関連していることが特徴である。これに比 べ、認知症は一般的に、(脳卒中や外傷の場合を除き)長くゆっくりと発症し、精神機能がゆっくりと低下し、経過も長い(数ヵ月から数年)[99]。 うつ病や精神病を含むいくつかの精神疾患は、せん妄や認知症とは区別されなければならない症状を引き起こすことがある[100]。これらは仮性認知症とし て診断され、認知症の評価には、Neuropsychiatric InventoryやGeriatric Depression Scaleなどのうつ病スクリーニングを含める必要がある[101][13]。しかし、研究者たちは、記憶障害を訴える高齢者の多くが、実際には認知症の 初期段階である軽度認知障害であることに気づいている。しかし、記憶障害のある高齢者にとって、うつ病は常に可能性のリストの上位に残るべきである。思 考、聴覚、視覚の変化は正常な加齢に伴うものであり、類似性があるために認知症の診断の際に問題となることがある[102]。認知症の発症を予測し、認知 症の診断を下すという困難な性質を考えると、機械学習や人工知能に支えられた臨床判断支援は、臨床診療を強化する可能性がある[103]。 認知機能検査 以下も参照のこと: 認知抑制と遂行機能障害 §検査と測定  様々な簡単な認知機能検査(5~15分)は、認知症のスクリーニングに妥当な信頼性があるが、年齢、教育、民族性などの要因に影響される可能性がある [106]。例えば、低学歴者は高学歴者よりも認知症と診断される可能性が高い[107]。多くの検査が研究されているが[108][109] [110]、現在ではmini mental state examination(MMSE)が最もよく研究され、最も一般的に使用されている。MMSEは、その結果をその人の性格、日常生活活動の能力、および 行動の評価とともに解釈すれば、認知症の診断に役立つ有用なツールである[4]。その他の認知機能検査には、略記メンタルテストスコア(AMTS)、「修 正ミニメンタルステート検査」(3MS)[111]、認知能力スクリーニング検査(CASI)[112]、トレイルメイキング検査[113]、および時計 描画検査がある。 [34] MoCA(Montreal Cognitive Assessment)は信頼性の高いスクリーニング検査であり、35の異なる言語でオンラインで無料で利用できる[13]。研究者らは、正確で信頼性が 高く、質問を聞いて答える必要がないMoCAテストの改良版を開発した[115][116]。 AD-8(認知機能低下に関連する機能の変化を評価するために使用されるスクリーニング質問紙)は、潜在的に有用であるが、診断的ではなく、変動が大き く、バイアスの危険性がある。 [117] 統合認知評価(CognICA)は、認知症の初期段階に対して高感度の5分間の検査であり、iPadに配信可能なアプリケーションを使用する[118] [119] 。 認知症スクリーニングのもう一つのアプローチは、インフォーマント(親族または他の支援者)にその人の日常的な認知機能についての質問票に記入してもらう ことである。インフォーマントアンケートは、簡単な認知機能検査を補完する情報を提供する。この種の質問票として最もよく知られているのは、高齢者の認知 機能低下に関する情報提供者質問票(IQCODE)であろう[120]。IQCODEが認知症の診断や予測にどの程度正確であるかについては、十分な証拠 がない[121]。介護者によるアルツハイマー病の診断の精度は約90%である[13]。General Practitioner Assessment Of Cognitionは、患者アセスメントとインフォーマントインタビューの両方を組み合わせたものである。これは、特にプライマリケアでの使用のために設 計された。 臨床神経心理士は、さまざまなタイプの認知症に関連する機能低下のパターンを決定するために、しばしば数時間に及ぶ認知機能検査のフルバッテリーを実施し た後、診断コンサルテーションを行う。記憶力、実行機能、処理速度、注意力、言語能力などの検査に加え、感情や心理的適応の検査も行われる。これらの検査 は、他の病因を除外し、経時的または以前の認知能力の推定値から相対的な認知機能の低下を判定するのに役立つ [122] 。 臨床検査 ルーチンの血液検査は通常、治療可能な原因を除外するために行われる。これには、ビタミンB12、葉酸、甲状腺刺激ホルモン(TSH)、C反応性蛋白、全 血球数、電解質、カルシウム、腎機能、および肝酵素の検査が含まれる。異常は、ビタミン欠乏症、感染症、または高齢者によくみられる錯乱や見当識障害を引 き起こすその他の問題を示唆している可能性がある [123] 。 画像検査 CTスキャンまたはMRIスキャンは、潜在的に可逆的な認知症の原因である正常圧水頭症または連結腫瘍を発見するために一般的に行われる。また、血管性認 知症を示唆する梗塞(脳卒中)など、他のタイプの認知症に関連する情報を得ることもできる。これらの検査では、神経学的検査で肉眼的な神経学的問題(麻痺 や脱力など)を示さない人の認知症に関連するびまん性代謝変化は検出されない[124]。 SPECTおよびPETの機能的神経画像モダリティは、臨床検査および認知機能検査と同様の認知症診断能力を示しているため、長期にわたる認知機能障害の 評価においてより有用である[125]。 放射性トレーサーとしてピッツバーグ化合物B(PiB)を用いたPiB-PETイメージングの価値は、特にアルツハイマー病の予測診断において確立されて いる[127]。 |
| Prevention Main article: Prevention of dementia Risk factors See also: Neuroplastic effects of pollution Risk factors for dementia include high blood pressure, high levels of LDL cholesterol, vision loss, hearing loss, smoking, obesity, depression, inactivity, diabetes, lower levels of education and low social contact. Over-indulgence in alcohol, lack of sleep, anemia, traumatic brain injury, and air pollution can also increase the chance of developing dementia.[7][128][129][130] Many of these risk factors, including the lower level of education, smoking, physical inactivity and diabetes, are modifiable.[131] Several of the group are known as vascular risk factors that may be possible to be reduced or eliminated.[132] Managing these risk factors can reduce the risk of dementia in individuals in their late midlife or older age. A reduction in a number of these risk factors can give a positive outcome.[133] The decreased risk achieved by adopting a healthy lifestyle is seen even in those with a high genetic risk.[134] In addition to the above risk factors, other psychological features, including certain personality traits (high neuroticism, and low conscientiousness), low purpose in life, and high loneliness, are risk factors for Alzheimer's disease and related dementias.[135][136][137] For example, based on the English Longitudinal Study of Ageing (ELSA), research found that loneliness in older people can increase the risk of dementia by one-third. Not having a partner (being single, divorced, or widowed) can double the risk of dementia. However, having two or three closer relationships might reduce the risk by three-fifths.[138][139] The two most modifiable risk factors for dementia are physical inactivity and lack of cognitive stimulation.[140] Physical activity, in particular aerobic exercise, is associated with a reduction in age-related brain tissue loss, and neurotoxic factors thereby preserving brain volume and neuronal integrity. Cognitive activity strengthens neural plasticity and together they help to support cognitive reserve. The neglect of these risk factors diminishes this reserve.[140] Sensory impairments of vision and hearing are modifiable risk factors for dementia.[141] These impairments may precede the cognitive symptoms of Alzheimer's disease for example, by many years.[142] Hearing loss may lead to social isolation which negatively affects cognition.[143] Social isolation is also identified as a modifiable risk factor.[142] Age-related hearing loss in midlife is linked to cognitive impairment in late life, and is seen as a risk factor for the development of Alzheimer's disease and dementia. Such hearing loss may be caused by a central auditory processing disorder that makes the understanding of speech against background noise difficult. Age-related hearing loss is characterised by slowed central processing of auditory information.[142][144] Worldwide, mid-life hearing loss may account for around 9% of dementia cases.[145] Frailty may increase the risk of cognitive decline, and dementia, and the inverse also holds of cognitive impairment increasing the risk of frailty. Prevention of frailty may help to prevent cognitive decline.[142] There are no medications that can prevent cognitive decline and dementia.[146] However blood pressure lowering medications might decrease the risk of dementia or cognitive problems by around 0.5%.[147] Economic disadvantage has been shown to have a strong link to higher dementia prevalence,[148] which cannot yet be fully explained by other risk factors. Dental health Limited evidence links poor oral health to cognitive decline. However, failure to perform tooth brushing and gingival inflammation can be used as dementia risk predictors.[149] Oral bacteria The link between Alzheimer's and gum disease is oral bacteria.[150] In the oral cavity, bacterial species include P. gingivalis, F. nucleatum, P. intermedia, and T. forsythia. Six oral treponema spirochetes have been examined in the brains of Alzheimer's patients.[151] Spirochetes are neurotropic in nature, meaning they act to destroy nerve tissue and create inflammation. Inflammatory pathogens are an indicator of Alzheimer's disease and bacteria related to gum disease have been found in the brains of patients with Alzheimer's disease.[151] The bacteria invade nerve tissue in the brain, increasing the permeability of the blood–brain barrier and promoting the onset of Alzheimer's. Individuals with a plethora of tooth plaque risk cognitive decline.[152] Poor oral hygiene can have an adverse effect on speech and nutrition, causing general and cognitive health decline. Oral viruses Herpes simplex virus (HSV) has been found in more than 70% of those aged over 50. HSV persists in the peripheral nervous system and can be triggered by stress, illness or fatigue.[151] High proportions of viral-associated proteins in amyloid plaques or neurofibrillary tangles (NFTs) confirm the involvement of HSV-1 in Alzheimer's disease pathology. NFTs are known as the primary marker of Alzheimer's disease. HSV-1 produces the main components of NFTs.[153] Diet Diet is seen to be a modifiable risk factor for the development of dementia. Thiamine deficiency is identified to increase the risk of Alzheimer's disease in adults.[154] The role of thiamine in brain physiology is unique and essential for the normal cognitive function of older people.[155] Many dietary choices of the elderly population, including the higher intake of gluten-free products, compromise the intake of thiamine as these products are not fortified with thiamine.[156] The Mediterranean and DASH diets are both associated with less cognitive decline. A different approach has been to incorporate elements of both of these diets into one known as the MIND diet.[157] These diets are generally low in saturated fats while providing a good source of carbohydrates, mainly those that help stabilize blood sugar and insulin levels.[158] Raised blood sugar levels over a long time, can damage nerves and cause memory problems if they are not managed.[159] Nutritional factors associated with the proposed diets for reducing dementia risk include unsaturated fatty acids, vitamin E, vitamin C, flavonoids, vitamin B, and vitamin D.[160][161] A study conducted at the University of Exeter in the United Kingdom seems to have confirmed these findings with fruits, vegetables, whole grains, and healthy fats creating an optimum diet that can help reduce the risk of dementia by roughly 25%.[162] The MIND diet may be more protective but further studies are needed. The Mediterranean diet seems to be more protective against Alzheimer's than DASH but there are no consistent findings against dementia in general. The role of olive oil needs further study as it may be one of the most important components in reducing the risk of cognitive decline and dementia.[157][163] In those with celiac disease or non-celiac gluten sensitivity, a strict gluten-free diet may relieve the symptoms given a mild cognitive impairment.[90][91] Once dementia is advanced no evidence suggests that a gluten-free diet is useful.[90] Omega-3 fatty acid supplements do not appear to benefit or harm people with mild to moderate symptoms.[164] However, there is good evidence that omega-3 incorporation into the diet is of benefit in treating depression, a common symptom,[165] and potentially modifiable risk factor for dementia.[7] Management Main article: Caring for people with dementia There are limited options for treating dementia, with most approaches focused on managing or reducing individual symptoms. There are no treatment options available to delay the onset of dementia.[166] Acetylcholinesterase inhibitors are often used early in the disorder course; however, benefit is generally small.[8][167] More than half of people with dementia may experience psychological or behavioral symptoms including agitation, sleep problems, aggression, and/or psychosis. Treatment for these symptoms is aimed at reducing the person's distress and keeping the person safe. Treatments other than medication appear to be better for agitation and aggression.[168] Cognitive and behavioral interventions may be appropriate. Some evidence suggests that education and support for the person with dementia, as well as caregivers and family members, improves outcomes.[169] Palliative care interventions may lead to improvements in comfort in dying, but the evidence is low.[170] Exercise programs are beneficial with respect to activities of daily living, and potentially improve dementia.[171] The effect of therapies can be evaluated for example by assessing agitation using the Cohen-Mansfield Agitation Inventory (CMAI); by assessing mood and engagement with the Menorah Park Engagement Scale (MPES);[172] and the Observed Emotion Rating Scale (OERS)[173] or by assessing indicators for depression using the Cornell Scale for Depression in Dementia (CSDD)[174] or a simplified version thereof.[175] Often overlooked in treating and managing dementia is the role of the caregiver and what is known about how they can support multiple interventions. Findings from a 2021 systematic review of the literature found caregivers of people with dementia in nursing homes do not have sufficient tools or clinical guidance for behavioral and psychological symptoms of dementia (BPSD) along with medication use.[176] Simple measures like talking to people about their interests can improve the quality of life for care home residents living with dementia. A programme showed that such simple measures reduced residents' agitation and depression. They also needed fewer GP visits and hospital admissions, which also meant that the programme was cost-saving.[177][178] Psychological and psychosocial therapies Main article: Psychological therapies for dementia Psychological therapies for dementia include some limited evidence for reminiscence therapy (namely, some positive effects in the areas of quality of life, cognition, communication and mood – the first three particularly in care home settings),[179] some benefit for cognitive reframing for caretakers,[180] unclear evidence for validation therapy[181] and tentative evidence for mental exercises, such as cognitive stimulation programs for people with mild to moderate dementia.[182] Offering personally tailored activities may help reduce challenging behavior and may improve quality of life.[183] It is not clear if personally tailored activities have an impact on affect or improve for the quality of life for the caregiver.[183] Adult daycare centers as well as special care units in nursing homes often provide specialized care for dementia patients. Daycare centers offer supervision, recreation, meals, and limited health care to participants, as well as providing respite for caregivers. In addition, home care can provide one-to-one support and care in the home allowing for more individualized attention that is needed as the disorder progresses. Psychiatric nurses can make a distinctive contribution to people's mental health.[184] Since dementia impairs normal communication due to changes in receptive and expressive language, as well as the ability to plan and problem solve, agitated behavior is often a form of communication for the person with dementia. Actively searching for a potential cause, such as pain, physical illness, or overstimulation can be helpful in reducing agitation.[185] Additionally, using an "ABC analysis of behavior" can be a useful tool for understanding behavior in people with dementia. It involves looking at the antecedents (A), behavior (B), and consequences (C) associated with an event to help define the problem and prevent further incidents that may arise if the person's needs are misunderstood.[186] The strongest evidence for non-pharmacological therapies for the management of changed behaviors in dementia is for using such approaches.[187] Low quality evidence suggests that regular (at least five sessions of) music therapy may help institutionalized residents. It may reduce depressive symptoms and improve overall behaviors. It may also supply a beneficial effect on emotional well-being and quality of life, as well as reduce anxiety.[188] In 2003, The Alzheimer's Society established 'Singing for the Brain' (SftB) a project based on pilot studies which suggested that the activity encouraged participation and facilitated the learning of new songs. The sessions combine aspects of reminiscence therapy and music.[189] Musical and interpersonal connectedness can underscore the value of the person and improve quality of life.[190] Some London hospitals found that using color, designs, pictures and lights helped people with dementia adjust to being at the hospital. These adjustments to the layout of the dementia wings at these hospitals helped patients by preventing confusion.[191] Life story work as part of reminiscence therapy, and video biographies have been found to address the needs of clients and their caregivers in various ways, offering the client the opportunity to leave a legacy and enhance their personhood and also benefitting youth who participate in such work. Such interventions can be more beneficial when undertaken at a relatively early stage of dementia. They may also be problematic in those who have difficulties in processing past experiences[190] Animal-assisted therapy has been found to be helpful. Drawbacks may be that pets are not always welcomed in a communal space in the care setting. An animal may pose a risk to residents, or may be perceived to be dangerous. Certain animals may also be regarded as "unclean" or "dangerous" by some cultural groups.[190] Occupational therapy also addresses psychological and psychosocial needs of patients with dementia through improving daily occupational performance and caregivers' competence.[192] When compensatory intervention strategies are added to their daily routine, the level of performance is enhanced and reduces the burden commonly placed on their caregivers.[192] Occupational therapists can also work with other disciplines to create a client centered intervention.[193] To manage cognitive disability, and coping with behavioral and psychological symptoms of dementia, combined occupational and behavioral therapies can support patients with dementia even further.[193] Cognitive training and rehabilitation There is no strong evidence to suggest that cognitive training is beneficial for people with Parkinson's disease, dementia, or mild cognitive impairment.[194] However, a 2023 review found that cognitive rehabilitation may be effective in helping individuals with mild to moderate dementia to manage their daily activities.[195] Personally tailored activities Offering personally tailored activity sessions to people with dementia in long-term care homes may slightly reduce challenging behavior.[196] Medications No medications have been shown to prevent or cure dementia.[197] Medications may be used to treat the behavioral and cognitive symptoms, but have no effect on the underlying disease process.[13][198] Donepezil Acetylcholinesterase inhibitors, such as donepezil, may be useful for Alzheimer's disease,[199] Parkinson's disease dementia, DLB, or vascular dementia.[198] The quality of the evidence is poor[200] and the benefit is small.[8] No difference has been shown between the agents in this family.[201] In a minority of people side effects include a slow heart rate and fainting.[202] Rivastigmine is recommended for treating symptoms in Parkinson's disease dementia.[64] Medications that have anticholinergic effects increase all-cause mortality in people with dementia, although the effect of these medications on cognitive function remains uncertain, according to a systematic review published in 2021.[203] Before prescribing antipsychotic medication in the elderly, an assessment for an underlying cause of the behavior is needed.[204] Severe and life-threatening reactions occur in almost half of people with DLB,[75][205] and can be fatal after a single dose.[206] People with Lewy body dementias who take neuroleptics are at risk for neuroleptic malignant syndrome, a life-threatening illness.[207] Extreme caution is required in the use of antipsychotic medication in people with DLB because of their sensitivity to these agents.[74] Antipsychotic drugs are used to treat dementia only if non-drug therapies have not worked, and the person's actions threaten themselves or others.[208][209][210][211] Aggressive behavior changes are sometimes the result of other solvable problems, that could make treatment with antipsychotics unnecessary.[208] Because people with dementia can be aggressive, resistant to their treatment, and otherwise disruptive, sometimes antipsychotic drugs are considered as a therapy in response.[208] These drugs have risky adverse effects, including increasing the person's chance of stroke and death.[208] Given these adverse events and small benefit antipsychotics are avoided whenever possible.[187] Generally, stopping antipsychotics for people with dementia does not cause problems, even in those who have been on them a long time.[212] N-methyl-D-aspartate (NMDA) receptor blockers such as memantine may be of benefit but the evidence is less conclusive than for AChEIs.[199] Due to their differing mechanisms of action memantine and acetylcholinesterase inhibitors can be used in combination however the benefit is slight.[213][214] An extract of Ginkgo biloba known as EGb 761 has been widely used for treating mild to moderate dementia and other neuropsychiatric disorders.[215] Its use is approved throughout Europe.[216] The World Federation of Biological Psychiatry guidelines lists EGb 761 with the same weight of evidence (level B) given to acetylcholinesterase inhibitors, and memantine. EGb 761 is the only one that showed improvement of symptoms in both AD and vascular dementia. EGb 761 is seen as being able to play an important role either on its own or as an add-on particularly when other therapies prove ineffective.[215] EGb 761 is seen to be neuroprotective; it is a free radical scavenger, improves mitochondrial function, and modulates serotonin and dopamine levels. Many studies of its use in mild to moderate dementia have shown it to significantly improve cognitive function, activities of daily living, neuropsychiatric symptoms, and quality of life.[215][217] However, its use has not been shown to prevent the progression of dementia.[215] While depression is frequently associated with dementia, the use of antidepressants such as selective serotonin reuptake inhibitors (SSRIs) do not appear to affect outcomes.[218][219] However, the SSRIs sertraline and citalopram have been demonstrated to reduce symptoms of agitation, compared to placebo.[220] No solid evidence indicates that folate or vitamin B12 improves outcomes in those with cognitive problems.[221] Statins have no benefit in dementia.[222] Medications for other health conditions may need to be managed differently for a person who has a dementia diagnosis. It is unclear whether blood pressure medication and dementia are linked. People may experience an increase in cardiovascular-related events if these medications are withdrawn.[223] The Medication Appropriateness Tool for Comorbid Health Conditions in Dementia (MATCH-D) criteria can help identify ways that a diagnosis of dementia changes medication management for other health conditions.[224] These criteria were developed because people with dementia live with an average of five other chronic diseases, which are often managed with medications. The systematic review that informed the criteria were published subsequently in 2018 and updated in 2022.[225] Sleep disturbances Over 40% of people with dementia report sleep problems. Approaches to treating these sleep problems include medications and non-pharmacological approaches.[226] The use of medications to alleviate sleep disturbances that people with dementia often experience has not been well researched, even for medications that are commonly prescribed.[227] In 2012 the American Geriatrics Society recommended that benzodiazepines such as diazepam, and non-benzodiazepine hypnotics, be avoided for people with dementia due to the risks of increased cognitive impairment and falls.[228] Benzodiazepines are also known to promote delirium.[229] Additionally, little evidence supports the effectiveness of benzodiazepines in this population.[227][230] No clear evidence shows that melatonin or ramelteon improves sleep for people with dementia due to Alzheimer's,[227] but it is used to treat REM sleep behavior disorder in dementia with Lewy bodies.[75] Limited evidence suggests that a low dose of trazodone may improve sleep, however more research is needed.[227] Non-pharmacological approaches have been suggested for treating sleep problems for those with dementia, however, there is no strong evidence or firm conclusions on the effectiveness of different types of interventions, especially for those who are living in an institutionalized setting such as a nursing home or long-term care home.[226] Pain See also: Assessment in nonverbal patients and Pain Assessment in Advanced Dementia As people age, they experience more health problems, and most health problems associated with aging carry a substantial burden of pain; therefore, between 25% and 50% of older adults experience persistent pain. Seniors with dementia experience the same prevalence of conditions likely to cause pain as seniors without dementia.[231] Pain is often overlooked in older adults and, when screened for, is often poorly assessed, especially among those with dementia, since they become incapable of informing others of their pain.[231][232] Beyond the issue of humane care, unrelieved pain has functional implications. Persistent pain can lead to decreased ambulation, depressed mood, sleep disturbances, impaired appetite, and exacerbation of cognitive impairment[232] and pain-related interference with activity is a factor contributing to falls in the elderly.[231][233] Although persistent pain in people with dementia is difficult to communicate, diagnose, and treat, failure to address persistent pain has profound functional, psychosocial and quality of life implications for this vulnerable population. Health professionals often lack the skills and usually lack the time needed to recognize, accurately assess and adequately monitor pain in people with dementia.[231][234] Family members and friends can make a valuable contribution to the care of a person with dementia by learning to recognize and assess their pain. Educational resources and observational assessment tools are available.[231][235][236] Eating difficulties Persons with dementia may have difficulty eating. Whenever it is available as an option, the recommended response to eating problems is having a caretaker assist them.[208] A secondary option for people who cannot swallow effectively is to consider gastrostomy feeding tube placement as a way to give nutrition. However, in bringing comfort and maintaining functional status while lowering risk of aspiration pneumonia and death, assistance with oral feeding is at least as good as tube feeding.[208][237] Tube-feeding is associated with agitation, increased use of physical and chemical restraints and worsening pressure ulcers. Tube feedings may cause fluid overload, diarrhea, abdominal pain, local complications, less human interaction and may increase the risk of aspiration.[238][239] Benefits in those with advanced dementia has not been shown.[240] The risks of using tube feeding include agitation, rejection by the person (pulling out the tube, or otherwise physical or chemical immobilization to prevent them from doing this), or developing pressure ulcers.[208] The procedure is directly related to a 1% fatality rate[241] with a 3% major complication rate.[242] The percentage of people at end of life with dementia using feeding tubes in the US has dropped from 12% in 2000 to 6% as of 2014.[243][244] The immediate and long-term effects of modifying the thickness of fluids for swallowing difficulties in people with dementia are not well known.[245] While thickening fluids may have an immediate positive effect on swallowing and improving oral intake, the long-term impact on the health of the person with dementia should also be considered.[245] Exercise Further information: Neurobiological effects of physical exercise Exercise programs may improve the ability of people with dementia to perform daily activities, but the best type of exercise is still unclear.[246] Getting more exercise can slow the development of cognitive problems such as dementia, proving to reduce the risk of Alzheimer's disease by about 50%. A balance of strength exercise, to help muscles pump blood to the brain, and balance exercises are recommended for aging people. A suggested amount of about 2+1⁄2 hours per week can reduce risks of cognitive decay as well as other health risks like falling.[247] Assistive technology There is a lack of high-quality evidence to determine whether assistive technology effectively supports people with dementia to manage memory issues.[248] Some of the specific things that are used today that helps with dementia today are: clocks, communication aids, electrical appliances the use monitoring, GPS location/ tracking devices, home care robots, in-home cameras, and medication management are just to name a few.[249] Technology has the potential to be a valuable intervention for alleviating loneliness and promoting social connections, supported by available evidence.[250] Alternative medicine Evidence of the therapeutic values of aromatherapy and massage is unclear.[251][252] It is not clear if cannabinoids are harmful or effective for people with dementia.[253] Palliative care Given the progressive and terminal nature of dementia, palliative care can be helpful to patients and their caregivers by helping people with the disorder and their caregivers understand what to expect, deal with loss of physical and mental abilities, support the person's wishes and goals including surrogate decision making, and discuss wishes for or against CPR and life support.[254][255] Because the decline can be rapid, and because most people prefer to allow the person with dementia to make their own decisions, palliative care involvement before the late stages of dementia is recommended.[256][257] Further research is required to determine the appropriate palliative care interventions and how well they help people with advanced dementia.[170] Person-centered care helps maintain the dignity of people with dementia.[258] Remotely delivered information for caregivers Remotely delivered interventions including support, training and information may reduce the burden for the informal caregiver and improve their depressive symptoms.[259] There is no certain evidence that they improve health-related quality of life.[259] In several localities in Japan, digital surveillance may be made available to family members, if a dementia patient is prone to wandering and going missing.[260] |
予防 主な記事 認知症の予防 危険因子 こちらも参照のこと: 公害の神経可塑的影響 認知症の危険因子には、高血圧、高LDLコレステロール値、視力低下、難聴、喫煙、肥満、うつ病、運動不足、糖尿病、低学歴、社会的接触の少なさなどがあ る。また、過度のアルコール摂取、睡眠不足、貧血、外傷性脳損傷、大気汚染も認知症発症の可能性を高める可能性がある[7][128][129] [130]。教育水準の低さ、喫煙、運動不足、糖尿病など、これらの危険因子の多くは修正可能である[131]。 これらの危険因子のうちいくつかは血管危険因子として知られており、低減または除去が可能である[132]。これらの危険因子を管理することで、中年期後 期または高齢者の認知症リスクを低減することができる。健康的な生活様式を採用することによって得られるリスクの低下は、遺伝的リスクが高い人にもみられ る[134]。 上記の危険因子に加えて、特定の性格特性(高い神経質性、低い良心性)、低い生きがい、高い孤独感などの他の心理的特徴もアルツハイマー病および関連する 認知症の危険因子である[135][136][137]。例えば、English Longitudinal Study of Ageing(ELSA)に基づく研究では、高齢者の孤独感は認知症のリスクを3分の1増加させることがわかった。パートナーがいないこと(独身、離婚、 寡婦)は認知症のリスクを2倍にする。しかし、より親密な関係を2~3人持つことで、リスクは5分の3に減少する可能性がある[138][139]。 身体活動、特に有酸素運動は、加齢に伴う脳組織の減少や神経毒性因子の減少と関連し、脳の容積と神経細胞の完全性を維持する。認知活動は神経可塑性を強化 し、両者が相まって認知予備能を支えるのに役立つ。これらの危険因子を無視すると、この予備能が低下する[140]。 視覚と聴覚の感覚障害は、認知症の修正可能な危険因子である[141]。 これらの障害は、例えばアルツハイマー病の認知症状に何年も先行する可能性がある[142]。 社会的孤立も修正可能な危険因子として同定されている[143]。このような難聴は、背景雑音に対する会話の理解を困難にする中枢聴覚処理障害によって引 き起こされる可能性がある。加齢に伴う難聴は、聴覚情報の中枢処理が遅くなることで特徴づけられる[142][144]。世界的には、中年期の難聴は認知 症患者の約9%を占めるとされている[145]。 虚弱は認知機能低下や認知症のリスクを増加させる可能性があり、認知機能障害が虚弱のリスクを増加させるという逆も成り立つ。虚弱の予防は認知機能低下の 予防に役立つ可能性がある[142]。 認知機能低下や認知症を予防できる薬はない[146]が、血圧降下薬は認知症や認知障害のリスクを0.5%程度減少させる可能性がある[147]。 経済的不利はより高い認知症有病率と強い関連があることが示されているが[148]、これは他の危険因子ではまだ完全に説明できない。 歯の健康 口腔の健康不良と認知機能低下を関連付ける証拠は限られている。しかし、歯磨きの不徹底や歯肉の炎症は認知症のリスク予測因子として使用できる [149]。 口腔細菌 アルツハイマー病と歯周病との関連は、口腔内細菌である[150]。口腔内には、P. gingivalis、F. nucleatum、P. intermedia、およびT. forsythiaなどの細菌種が存在する。スピロヘータは神経向性であり、神経組織を破壊して炎症を引き起こす。炎症性病原体はアルツハイマー病の指標 であり、歯周病に関連する細菌がアルツハイマー病患者の脳から検出されている[151]。細菌は脳の神経組織に侵入し、血液脳関門の透過性を高め、アルツ ハイマー病の発症を促進する。歯垢の多い人は認知機能が低下するリスクがある[152]。口腔衛生状態が悪いと、会話や栄養に悪影響を及ぼし、全身および 認知機能の低下を引き起こす。 口腔ウイルス 単純ヘルペスウイルス(HSV)は、50歳以上の70%以上で検出されている。HSVは末梢神経系に持続し、ストレス、病気または疲労によって誘発される ことがある。 [151] アミロイド斑または神経原線維変化(NFT)中のウイルス関連タンパク質の割合が高いことから、アルツハイマー病の病態におけるHSV-1の関与が確認さ れている。NFTはアルツハイマー病の主要なマーカーとして知られている。HSV-1はNFTの主成分を産生する[153]。 食事 食事は認知症発症の修正可能な危険因子であると考えられている。脳の生理学におけるチアミンの役割は独特であり、高齢者の正常な認知機能にとって不可欠で ある[155]。グルテンフリー製品の摂取量の増加など、高齢者の多くの食事選択は、これらの製品がチアミンで強化されていないため、チアミンの摂取を損 なう[156]。 地中海食とDASH食は、いずれも認知機能の低下が少ないことと関連している。これらの食事は一般に飽和脂肪酸が少なく、一方で炭水化物、主に血糖値とイ ンスリンレベルの安定化に役立つ炭水化物を多く含んでいる[158]。 [159]認知症のリスクを減らすために提案されている食事に関連する栄養因子には、不飽和脂肪酸、ビタミンE、ビタミンC、フラボノイド、ビタミンB、 ビタミンDなどがある[160][161]。イギリスのエクセター大学で行われた研究では、果物、野菜、全粒穀物、健康的な脂肪が、認知症のリスクをおよ そ25%減少させるのに役立つ最適な食事を作り出しており、これらの知見が確認されたようである[162]。 MIND食はより認知症予防効果が高いかもしれないが、さらなる研究が必要である。地中海食はDASH食よりもアルツハイマー病の予防効果が高いようであ るが、認知症全般に対する一貫した知見は得られていない。オリーブ油の役割は、認知機能の低下および認知症のリスクを減少させる上で最も重要な成分の1つ である可能性があるため、さらなる研究が必要である[157][163]。 セリアック病または非セリアック性グルテン過敏症の患者では、厳格なグルテン除去食が軽度認知障害の症状を緩和する可能性がある[90][91]。 認知症が進行すると、グルテン除去食が有用であることを示唆する証拠はない[90]。 オメガ3脂肪酸のサプリメントは、軽度から中等度の症状の人には有益でも有害でもないようである[164]。しかし、オメガ3を食事に取り入れることは、 一般的な症状であり[165]、潜在的に認知症の修正可能な危険因子であるうつ病の治療に有益であるという十分な証拠がある[7]。 管理 主な記事 認知症患者のケア 認知症を治療するための選択肢は限られており、ほとんどのアプローチは個々の症状を管理または軽減することに重点を置いている。認知症の発症を遅らせるた めの治療法はない[166]。アセチルコリンエステラーゼ阻害薬は認知症の初期にしばしば使用されるが、一般的にその効果は小さい[8][167]。これ らの症状に対する治療は、患者の苦痛を軽減し、安全を保つことを目的としている。興奮および攻撃性に対しては、薬物療法以外の治療法がより優れているよう である。認知症患者だけでなく、介護者や家族に対する教育や支援が転帰を改善することを示唆する証拠もある[169]。緩和ケア介入は死に臨む際の快適さ の改善につながる可能性があるが、証拠は少ない[170]。運動プログラムは日常生活動作に関して有益であり、認知症を改善する可能性がある[171]。 治療の効果は、例えば、Cohen-Mansfield Agitation Inventory(CMAI)を用いた興奮の評価、Menorah Park Engagement Scale(MPES)を用いた気分および関与の評価[172]、Observed Emotion Rating Scale(OERS)[173]、Cornell Scale for Depression in Dementia(CSDD)[174]またはその簡易版を用いた抑うつ指標の評価によって評価することができる[175]。 認知症の治療と管理において見落とされがちなのが介護者の役割であり、介護者が複数の介入をどのように支援できるかについて知られていることである。 2021年に行われた文献の系統的レビューの結果、介護施設に入所している認知症患者の介護者は、薬物使用とともに認知症の行動・心理症状(BPSD)に 対する十分なツールや臨床指導を受けていないことがわかった[176]。あるプログラムでは、このような単純な対策が入居者の興奮や抑うつを軽減すること が示された。また、GPの受診や入院の回数も減り、このプログラムはコスト削減にもつながった[177][178]。 心理学的・心理社会的療法 主な記事 認知症の心理療法 認知症に対する心理療法には、回想療法に対する限定的なエビデンス(生活の質、認知、コミュニケーション、気分の各分野におけるプラスの効果、特に最初の 3つはケアホームでの効果)[179]、介護者に対する認知的リフレーミングに対する若干の効果[180]、妥当性確認療法に対する不明確なエビデンス [181]、軽度から中等度の認知症患者に対する認知刺激プログラムなどの頭の体操に対する暫定的なエビデンス[182]などがある。 [182] 個人的に調整された活動を提供することは、挑戦的な行動を減らすのに役立ち、QOLを改善する可能性がある[183]が、個人的に調整された活動が情動に 影響を与えたり、介護者のQOLを改善したりするかどうかは明らかでない[183]。 成人デイケアセンターや老人ホームの特別ケアユニットでは、認知症患者に特化したケアを提供することが多い。デイケアセンターでは、参加者に監督、レクリ エーション、食事、限定的な医療ケアを提供し、介護者に休息を提供している。さらに、在宅ケアでは、障害が進行するにつれて必要とされる、より個別的な配 慮を可能にする1対1のサポートとケアを家庭で提供することができる。精神科看護師は、人々の精神的健康に対して際立った貢献をすることができる [184] 。 認知症は、受容言語や表現言語、また計画や問題解決能力の変化により、正常なコミュニケーショ ンが損なわれるため、興奮行動は認知症患者のコミュニケーションの一形態であることが多い。苦痛、身体疾患、過剰刺激などの潜在的な原因を積極的に探すこ とは、興奮を軽減するのに有用である[185]。さらに、「行動のABC分析」を用いることは、認知症の人の行動を理解するのに有用なツールである。これ は、ある出来事に関連する先行要因(A)、行動(B)、結果(C)に注目することで、問題を明確にし、本人のニーズが誤解された場合に発生する可能性のあ るさらなる出来事を防ぐのに役立つものである [186] 。認知症における変化した行動の管理のための非薬物療法については、このようなアプローチを用いることが最も有力なエビデンスである [187] 。質の低いエビデンスではあるが、定期的な(少なくとも5回の)音楽療法が施設入所者の助けとなる可能性が示唆されている。音楽療法は抑うつ症状を軽減 し、全体的な行動を改善する可能性がある。また、情緒的な幸福と生活の質に有益な効果をもたらし、不安を軽減する可能性もある [188] 。2003年、アルツハイマー病協会(The Alzheimer's Society)は、この活動が参加を促し、新しい歌の学習を促進することを示唆した試験的研究に基づいて、「脳のための歌唱(Singing for the Brain)」(SftB)プロジェクトを設立した。このセッションは、回想療法と音楽の側面を組み合わせたものである [189] 。音楽的および対人的なつながりは、その人の価値を強調し、生活の質を向上させることができる [190] 。 ロンドンのいくつかの病院では、色彩、デザイン、絵、照明などを使用することで、認知症の人が病院にいることに慣れることができることを発見した。これら の病院では、認知症病棟のレイアウトをこのように調整することで、混乱を防いで患者を支援している [191] 。 回想療法の一環としてのライフストーリー・ワークやビデオ伝記は、さまざまな方法でクライエントやその介護者のニーズに対応し、クライエントに遺産を残し て人間性を高める機会を提供するとともに、そのようなワークに参加する青少年にも有益であることがわかっている。このような介入は、認知症の比較的早い段 階で行われるとより有益である。また、過去の経験を処理することが困難な人には問題となることもある[190]。 動物介在療法は有用であることがわかっている。欠点は、介護の場においてペットが必ずしも共同スペースで歓迎されるとは限らないことである。動物が入所者 に危険を及ぼしたり、危険であると認識されたりする場合もある。またある種の動物は、文化集団によっては「不潔」または「危険」とみなされることもある [190] 。 作業療法はまた、日常的な作業能力の向上や介護者の能力向上を通じて、認知症患者の心理的・心理社会的ニーズに対応する[192]。代償的介入戦略を日常 生活に加えると、作業能力のレベルが向上し、介護者に一般的にかかる負担が軽減する[192]。作業療法士は他の専門分野と協力して、クライエント中心の 介入を行うこともできる[193]。認知障害を管理し、認知症の行動・心理症状に対処するために、作業療法と行動療法を組み合わせることで、認知症患者を さらに支援することができる[193]。 認知訓練とリハビリテーション 認知訓練がパーキンソン病、認知症、または軽度認知障害のある人に有益であることを示唆する強力な証拠はない[194]が、2023年のレビューによる と、認知リハビリテーションは軽度から中等度の認知症の人が日常生活を管理するのに有効である可能性がある[195]。 個人に合わせた活動 長期介護施設で認知症の人に個人的に調整された活動セッションを提供することで、挑戦的な行動がわずかに減少する可能性がある[196]。 薬物療法 認知症を予防または治癒する薬剤は示されていない[197]。 薬剤は行動および認知症状を治療するために使用されることがあるが、根本的な疾患プロセスには効果がない[13][198]。 ドネペジル ドネペジルなどのアセチルコリンエステラーゼ阻害薬は、アルツハイマー病、[199] パーキンソン病性認知症、DLB、または血管性認知症に有用である可能性がある[198] 。 2021年に発表された系統的レビューによると、抗コリン作用を有する薬剤は認知症患者の全死因死亡率を増加させるが、認知機能に対するこれらの薬剤の影 響は依然として不明である[203]。 高齢者に抗精神病薬を処方する前に、行動の根本的な原因に対する評価が必要である [204] [75] [205] 重篤で生命を脅かす反応は、DLB患者のほぼ半数にみられ、1回の投与で致命的となることもある [206] 。 神経遮断薬を服用しているレビー小体型認知症患者は、生命を脅かす疾患である神経遮断薬悪性症候群のリスクがある。 [207] DLB患者では抗精神病薬に対する感受性が高いため、抗精神病薬の使用には細心の注意が必要である。 [74] 抗精神病薬は、非薬物療法が奏効せず、患者の行動が自分自身や他人を脅かす場合にのみ認知症の治療に使用される。 [208][209][210][211]攻撃的な行動の変化は、解決可能な他の問題の結果であることもあり、抗精神病薬による治療が不要になることもあ る[208]。 [これらの薬物には、脳卒中や死亡の可能性を増加させるなどの危険な副作用がある[208]。これらの有害事象とわずかな有益性を考慮すると、抗精神病薬 は可能な限り避けられる[187]。一般的に、認知症患者に対する抗精神病薬の服用を中止しても、長期間服用している患者であっても問題は生じない [212]。 メマンチンなどのN-メチル-D-アスパラギン酸(NMDA)受容体遮断薬は有益であるが、AChEIに比べて決定的な証拠は少ない[199]。作用機序 が異なるため、メマンチンとアセチルコリンエステラーゼ阻害薬は併用できるが、その有益性はわずかである[213][214]。 EGb761として知られるイチョウ葉の抽出物は、軽度から中等度の認知症および他の精神神経疾患の治療に広く使用されている[215]。 その使用はヨーロッパ全域で承認されている[216]。世界生物学的精神医学連合(World Federation of Biological Psychiatry)のガイドラインでは、EGb761はアセチルコリンエステラーゼ阻害薬およびメマンチンと同じ証拠の重み(レベルB)を与えられて いる。EGb761は、ADと血管性痴呆の両方で症状の改善を示した唯一の薬剤である。EGb761は神経保護作用があると考えられており、フリーラジカ ル捕捉剤であり、ミトコンドリア機能を改善し、セロトニンとドーパミンのレベルを調節する。軽度から中等度の認知症における使用の多くの研究で、認知機 能、日常生活動作、精神神経症状、QOLを有意に改善することが示されている[215][217]が、その使用が認知症の進行を予防することは示されてい ない[215]。 うつ病はしばしば認知症と関連するが、選択的セロトニン再取り込み阻害薬(SSRI)などの抗うつ薬の使用は転帰に影響しないようである[218] [219]。しかし、SSRIのセルトラリンとシタロプラムは、プラセボと比較して興奮の症状を軽減することが実証されている[220]。 葉酸やビタミンB12が認知障害のある人の転帰を改善するという確かな証拠はない[221]。 スタチンは認知症に効果がない[222]。血圧の薬と認知症が関連しているかどうかは不明である。これらの薬剤を中止すると、心血管関連のイベントが増加 する可能性がある[223]。 MATCH-D(Medication Appropriateness Tool for Comorbid Health Conditions in Dementia)基準は、認知症の診断が他の健康状態の薬物管理をどのように変えるかを特定するのに役立つ[224]。この基準に影響を与えたシステマ ティックレビューは、その後2018年に発表され、2022年に更新された[225]。 睡眠障害 認知症患者の40%以上が睡眠障害を訴えている。これらの睡眠障害を治療するアプローチには、薬物療法と非薬物療法がある[226]。認知症患者がしばし ば経験する睡眠障害を緩和するための薬物の使用については、一般的に処方されている薬物であっても、十分な研究がなされていない[227]。2012年、 米国老年医学会は、認知機能障害と転倒を増加させる危険性があるため、認知症患者にはジアゼパムなどのベンゾジアゼピン系薬剤と非ベンゾジアゼピン系催眠 薬を避けるよう勧告した。 [228] ベンゾジアゼピンはせん妄を促進することも知られている[229]。さらに、この集団におけるベンゾジアゼピンの有効性を支持する証拠はほとんどない [227][230]。メラトニンまたはラメルテオンがアルツハイマー型認知症患者の睡眠を改善することを示す明確な証拠はないが[227]、レビー小体 型認知症のレム睡眠行動障害の治療に使用されている[75]。限られた証拠によると、低用量のトラゾドンが睡眠を改善する可能性があるが、さらなる研究が 必要である[227]。 非薬理学的アプローチは認知症患者の睡眠問題を治療するために提案されているが、特にナーシングホームや長期ケアホームなどの施設に入所している患者につ いては、さまざまなタイプの介入の有効性に関する強力な証拠や確固たる結論はない[226]。 疼痛 以下も参照のこと: 非言語性患者における評価および進行性認知症における疼痛評価 高齢になるにつれて、より多くの健康上の問題を経験するようになり、加齢に伴う健康上の問題のほとんどは、相当な痛みの負担を伴う。認知症の高齢者は、認 知症でない高齢者と同じように、痛みを引き起こしやすい病態の有病率を経験している[231] 。痛みは高齢者では見落とされがちであり、特に認知症の高齢者では、自分の痛みを他人に伝えることができなくなるため、痛みをスクリーニングしても評価が 不十分なことが多い[231][232]。持続的な痛みは、歩行能力の低下、抑うつ気分、睡眠障害、食欲不振、認知機能障害の悪化につながり[232]、 痛みに関連した活動障害は高齢者の転倒の一因となる[231][233]。 認知症患者の持続的な痛みは伝達、診断、治療が困難であるが、持続的な痛みに対処できないことは、この脆弱な集団にとって機能的、心理社会的、QOL的に 重大な影響を及ぼす。医療専門家は、認知症患者の痛みを認識し、正確に評価し、適切にモニタリングするために必要なスキルが不足していることが多く、通 常、時間がない[231][234]。家族や友人は、認知症患者の痛みを認識し評価することを学ぶことによって、認知症患者のケアに貴重な貢献をすること ができる。教育資料や観察評価ツールが利用できる[231][235][236]。 食べることの困難 認知症患者は食べることが困難な場合がある。選択肢として利用できる場合はいつでも、食事の問題に対する推奨される対応は、世話人に介助してもらうことで ある。[208] 効果的に飲み込むことができない人に対する二次的な選択肢は、栄養を与える方法として胃瘻からの栄養チューブ留置を検討することである。しかしながら、誤 嚥性肺炎および死亡のリスクを低下させながら快適さをもたらし、機能的状態を維持するという点では、経口栄養による支援は少なくとも経管栄養と同程度であ る[208][237]。経管栄養は、興奮、身体的および化学的拘束の使用の増加、褥瘡の悪化と関連している。経管栄養は、水分過多、下痢、腹痛、局所合 併症、人間関係の希薄化、誤嚥の危険性を高める可能性がある[238][239]。 進行した認知症患者における有益性は示されていない[240]。経管栄養を使用するリスクとしては、興奮、本人による拒絶(チューブを引き抜く、またはそ れを防ぐために物理的または化学的に固定する)、または褥瘡の発生がある[208]。この処置は1%の致死率[241]、3%の重大な合併症率と直接関係 している[242]。米国で経管栄養を使用している認知症の終末期患者の割合は、2000年の12%から2014年時点で6%に低下している[243] [244]。 認知症患者の嚥下障害に対して輸液の濃さを変更することの即時的および長期的な効果についてはよくわかっていない[245]。輸液を濃くすることは、嚥下 や経口摂取の改善に即座にプラスの効果をもたらすかもしれないが、認知症患者の健康への長期的な影響も考慮すべきである[245]。 運動 さらに詳しい情報 運動の神経生物学的効果 運動プログラムは認知症患者の日常生活能力を向上させる可能性があるが、どのような運動が最適であるかはまだ明らかになっていない[246]。高齢者に は、筋肉が脳に血液を送るのを助ける筋力運動とバランス運動をバランスよく行うことが推奨される。週に2+1⁄2時間程度を目安にすると、認知機能の低下 だけでなく、転倒などの他の健康リスクも軽減できる[247]。 補助技術 支援技術が認知症患者の記憶問題の管理を効果的に支援するかどうかを判断するための質の高いエビデンスは不足している[248]。今日、認知症を支援する ために使用されている具体的なものとしては、時計、コミュニケーション補助具、電気製品の使用監視、GPS位置/追跡装置、在宅介護ロボット、家庭内カメ ラ、服薬管理などが挙げられる[249]。利用可能なエビデンスによって裏付けられているように、技術は孤独感を緩和し、社会的つながりを促進するための 貴重な介入となる可能性を秘めている[250]。 代替医療 アロマセラピーやマッサージの治療効果に関するエビデンスは不明である[251][252]。 カンナビノイドが認知症患者にとって有害か有効かは明らかでない[253]。 緩和ケア 認知症が進行性で末期的であることを考慮すると、緩和ケアは、認知症患者とその介護者が、今後予想されることを理解し、身体的・精神的能力の喪失に対処 し、代理意思決定を含む本人の希望と目標を支援し、心肺蘇生と生命維持の希望の有無について話し合うことを支援することによって、患者とその介護者にとっ て有用である。 [254][255]認知症は急速に進行する可能性があり、また多くの人は認知症の人が自分で意思決定できることを望むため、認知症後期になる前に緩和ケ アに関与することが推奨されている[256][257]。適切な緩和ケア介入と、それが進行した認知症の人をどの程度助けるのかについては、さらなる研究 が必要である[170]。 パーソンセンタードケアは認知症患者の尊厳を保つのに役立つ[258]。 介護者のための遠隔情報提供 支援、訓練、情報提供を含む遠隔介入は、インフォーマルな介護者の負担を軽減し、彼らの抑うつ症状を改善する可能性がある[259]。 日本のいくつかの自治体では、認知症患者が徘徊や行方不明になりやすい場合、デジタル監視を家族が利用できるようにしている[260]。 |
Epidemiology  Deaths per million persons in 2012 due to dementia 0–4 5–8 9–10 11–13 14–17 18–24 25–45 46–114 115–375 376–1266  Disability-adjusted life year for Alzheimer and other dementias per 100,000 inhabitants in 2004 <100 100–120 120–140 140–160 160–180 180–200 200–220 220–240 240–260 260–280 280–300 >300 The number of cases of dementia worldwide in 2021 was estimated at 55 million, with close to 10 million new cases each year.[2] According to a report by the World Health Organization, "In 2021, Alzheimer’s disease and other forms of dementia ranked as the seventh leading cause of death, killing 1.8 million lives."[261] By 2050, the number of people living with dementia is estimated to be over 150 million globally.[262] Around 7% of people over the age of 65 have dementia, with slightly higher rates (up to 10% of those over 65) in places with relatively high life expectancy.[263] An estimated 58% of people with dementia are living in low and middle income countries.[264][265] The prevalence of dementia differs in different world regions, ranging from 4.7% in Central Europe to 8.7% in North Africa/Middle East; the prevalence in other regions is estimated to be between 5.6 and 7.6%.[264] The number of people living with dementia is estimated to double every 20 years. In 2016 dementia resulted in about 2.4 million deaths,[9] up from 0.8 million in 1990.[266] The genetic and environmental risk factors for dementia disorders vary by ethnicity.[267][268] For instance, Alzheimer's disease among Hispanic/Latino and African American subjects exhibit lower risks associated with gene changes in the apolipoprotein E gene than do non-Hispanic white subjects.[269] The annual incidence of dementia diagnosis is nearly 10 million worldwide.[170] Almost half of new dementia cases occur in Asia, followed by Europe (25%), the Americas (18%) and Africa (8%). The incidence of dementia increases exponentially with age, doubling with every 6.3-year increase in age.[264] Dementia affects 5% of the population older than 65 and 20–40% of those older than 85.[270] Rates are slightly higher in women than men at ages 65 and greater.[270] The disease trajectory is varied and the median time from diagnosis to death depends strongly on age at diagnosis, from 6.7 years for people diagnosed aged 60–69 to 1.9 years for people diagnosed at 90 or older.[170] Dementia impacts not only individuals with dementia, but also their carers and the wider society. Among people aged 60 years and over, dementia is ranked the 9th most burdensome condition according to the 2010 Global Burden of Disease (GBD) estimates. The global costs of dementia was around US$818 billion in 2015, a 35.4% increase from US$604 billion in 2010.[264] A new 2024 study reveals that deaths from dementia in the U.S. have tripled in the past 21 years, rising from around 150,000 in 1999 to over 450,000 in 2020; the likelihood of dying from dementia increased across all demographic groups studied.[271] Affected ages See also: Early onset dementia About 3% of people between the ages of 65–74 have dementia, 19% between 75 and 84, and nearly half of those over 85 years of age. As more people are living longer, dementia is becoming more common.[272] For people of a specific age, however, it may be becoming less frequent in the developed world, due to a decrease in modifiable risk factors made possible by greater financial and educational resources. It is one of the most common causes of disability among the elderly but can develop before the age of 65 when it is known as early-onset dementia or presenile dementia.[273][274] Less than 1% of those with Alzheimer's have gene mutations that cause a much earlier development of the disease, around the age of 45, known as early-onset Alzheimer's disease.[275] More than 95% of people with Alzheimer's disease have the sporadic form (late onset, 80–90 years of age).[275] Worldwide the cost of dementia in 2015 was put at US$818 billion. People with dementia are often physically or chemically restrained to a greater degree than necessary, raising issues of human rights.[2][276] Social stigma is commonly perceived by those with the condition, and also by their caregivers.[97] |
疫学 2012年の認知症による100万人当たりの死亡者数 0~4 5~8 9~10 11~13 14~17 18~24 25~45 46~114 115~375 376~1266  2004年における人口10万人当たりのアルツハイマー病およびその他の認知症による障害調整生命年数 <100 100~120 120~140 140~160 160~180 180~200 200~220 220~240 240–260 260–280 280–300 >300 2021年の世界における認知症患者数は5,500万人と推定され、毎年1,000万人近くが新たに発症している。[2] 世界保健機関(WHO)の報告書によると、「2021年には、アルツハイマー病およびその他の認知症が死因の第7位となり、180万人の命を奪っている」 [261]。 2050年までに、認知症患者数は世界で1億5,000万人を超えると推定されている。[262] 65歳以上の高齢者の約7%が認知症であり、平均余命が比較的長い地域では、その割合がやや高い(65歳以上の10%)。[263] 認知症患者の58%は、低・中所得国で暮らしていると推定されている 中所得国に居住している。[264][265] 認知症の有病率は世界の地域によって異なり、中央ヨーロッパでは4.7%、北アフリカ/中東では8.7%となっている。その他の地域の有病率は 5.6~7.6%と推定されている。[264] 認知症を抱えて生きる人々の数は、20年ごとに倍増すると推定されている。2016年には認知症による死亡者数は約240万人に達し、1990年の80万 人から増加している。[266] 認知症障害の遺伝的および環境的リスク要因は民族によって異なる。[267][268] 例えば、ヒスパニック系およびアフリカ系アメリカ人のアルツハイマー病では、非ヒスパニック系白人と比較してアポリポタンパク質E遺伝子の遺伝子変化に関 連するリスクが低いことが示されている。[269] 認知症と診断される患者数は世界で年間1,000万人近くに上る。[170] 新たに認知症と診断される患者のほぼ半数はアジアで発生しており、次いでヨーロッパ(25%)、南北アメリカ(18%)、アフリカ(8%)の順となってい る。認知症の発症率は年齢とともに指数関数的に増加し、6.3歳年齢が上がるごとに倍増する。[264] 認知症は65歳以上の人口の5%、85歳以上の人口の20~40%に影響を及ぼしている。[270] 65歳以上の年齢層では、男性よりも女性の方がわずかに発症率が高い。。[270] 病気の経過は様々であり、診断から死亡までの期間の中央値は、診断時の年齢に大きく依存している。60~69歳で診断された場合は6.7年であるのに対 し、90歳以上で診断された場合は1.9年である。[170] 認知症は、認知症患者本人だけでなく、介護者や社会全体にも影響を及ぼす。60歳以上の人口において、認知症は2010年の疾病負荷(GBD)推計による と、最も負担の大きい疾患の第9位にランクされている。2015年の認知症の世界的コストはおよそ8180億米ドルであり、2010年の6040億米ドル から35.4%増加している。[264] 2024年の新しい研究では、米国における認知症による死亡者数は過去21年間で3倍に増加しており、1999年には約15万人であったのが、2020年 には45万人を超えると推定されている。認知症による死亡の可能性は、調査対象となったすべての人口統計グループで増加している。[271] 影響を受ける年齢 参照:若年性認知症 65~74歳では約3%、75~84歳では約19%、85歳以上ではほぼ半数が認知症である。平均寿命が延びるにつれ、認知症もより一般的になってきてい る。[272] しかし、先進国では、経済的および教育的な資源の増加により修正可能な危険因子が減少しているため、特定の年齢層では、認知症は減少傾向にある可能性があ る。これは高齢者の障害の最も一般的な原因のひとつであるが、65歳以前に発症することもあり、早期発症型認知症または若年性認知症と呼ばれる。 [273][274] アルツハイマー病の患者のうち、遺伝子変異により45歳頃というかなり早い時期に発症するケースは1%未満である 早期発症型アルツハイマー病として知られている。アルツハイマー病の95%以上は散発型(遅発型、80~90歳)である。認知症患者は、必要以上に身体的 または化学的に拘束されることが多く、人権の問題を引き起こしている。[2][276] 社会的な偏見は、患者だけでなく介護者にも広く認識されている。[97] |
| History This section needs additional citations for verification. Please help improve this article by adding citations to reliable sources in this section. Unsourced material may be challenged and removed. (November 2015) (Learn how and when to remove this message) See also: Dementia praecox Until the end of the 19th century, dementia was a much broader clinical concept. It included mental illness and any type of psychosocial incapacity, including reversible conditions.[277] Dementia at this time simply referred to anyone who had lost the ability to reason, and was applied equally to psychosis, "organic" diseases like syphilis that destroy the brain, and to the dementia associated with old age, which was attributed to "hardening of the arteries".  A 19th-century drawing of a woman diagnosed with dementia Dementia has been referred to in medical texts since antiquity. One of the earliest known allusions to dementia is attributed to the 7th-century BC Greek philosopher Pythagoras, who divided the human lifespan into six distinct phases: 0–6 (infancy), 7–21 (adolescence), 22–49 (young adulthood), 50–62 (middle age), 63–79 (old age), and 80–death (advanced age). The last two he described as the "senium", a period of mental and physical decay, and that the final phase was when "the scene of mortal existence closes after a great length of time that very fortunately, few of the human species arrive at, where the mind is reduced to the imbecility of the first epoch of infancy".[278] In 550 BC, the Athenian statesman and poet Solon argued that the terms of a man's will might be invalidated if he exhibited loss of judgement due to advanced age. Chinese medical texts made allusions to the condition as well, and the characters for "dementia" translate literally to "foolish old person".[279] Athenian philosophers Aristotle and Plato discussed the mental decline that can come with old age and predicted that this affects everyone who becomes old and nothing can be done to stop this decline from taking place. Plato specifically talked about how the elderly should not be in positions that require responsibility because, "There is not much acumen of the mind that once carried them in their youth, those characteristics one would call judgement, imagination, power of reasoning, and memory. They see them gradually blunted by deterioration and can hardly fulfill their function."[280] For comparison, the Roman statesman Cicero held a view much more in line with modern-day medical wisdom that loss of mental function was not inevitable in the elderly and "affected only those old men who were weak-willed". He spoke of how those who remained mentally active and eager to learn new things could stave off dementia. However, Cicero's views on aging, although progressive, were largely ignored in a world that would be dominated for centuries by Aristotle's medical writings. Physicians during the Roman Empire, such as Galen and Celsus, simply repeated the beliefs of Aristotle while adding few new contributions to medical knowledge. Byzantine physicians sometimes wrote of dementia. It is recorded that at least seven emperors whose lifespans exceeded 70 years displayed signs of cognitive decline. In Constantinople, special hospitals housed those diagnosed with dementia or insanity, but these did not apply to the emperors, who were above the law and whose health conditions could not be publicly acknowledged. Otherwise, little is recorded about dementia in Western medical texts for nearly 1700 years. One of the few references was the 13th-century friar Roger Bacon, who viewed old age as divine punishment for original sin. Although he repeated existing Aristotelian beliefs that dementia was inevitable, he did make the progressive assertion that the brain was the center of memory and thought rather than the heart. Poets, playwrights, and other writers made frequent allusions to the loss of mental function in old age. William Shakespeare notably mentions it in plays such as Hamlet and King Lear. During the 19th century, doctors generally came to believe that elderly dementia was the result of cerebral atherosclerosis, although opinions fluctuated between the idea that it was due to blockage of the major arteries supplying the brain or small strokes within the vessels of the cerebral cortex. In 1907, Bavarian psychiatrist Alois Alzheimer was the first to identify and describe the characteristics of progressive dementia in the brain of 51-year-old Auguste Deter.[281] Deter had begun to behave uncharacteristically, including accusing her husband of adultery, neglecting household chores, exhibiting difficulties writing and engaging in conversations, heightened insomnia, and loss of directional sense.[282] At one point, Deter was reported to have "dragged a bed sheet outside, wandered around wildly, and cried for hours at midnight."[282] Alzheimer began treating Deter when she entered a Frankfurt mental hospital on November 25, 1901.[282] During her ongoing treatment, Deter and her husband struggled to afford the cost of the medical care, and Alzheimer agreed to continue her treatment in exchange for Deter's medical records and donation of her brain upon death.[282] Deter died on April 8, 1906, after succumbing to sepsis and pneumonia.[282] Alzheimer conducted the brain biopsy using the Bielschowsky stain method, which was a new development at the time, and he observed senile plaques, neurofibrillary tangles, and atherosclerotic alteration.[281] At the time, the consensus among medical doctors had been that senile plaques were generally found in older patients, and the occurrence of neurofibrillary tangles was an entirely new observation at the time.[282] Alzheimer presented his findings at the 37th psychiatry conference of southwestern Germany in Tübingen on April 11, 1906; however, the information was poorly received by his peers.[282] By 1910, Alois Alzheimer's teacher, Emil Kraepelin, published a book in which he coined the term "Alzheimer's disease" in an attempt to acknowledge the importance of Alzheimer's discovery.[281][282] By the 1960s, the link between neurodegenerative diseases and age-related cognitive decline had become more established. By the 1970s, the medical community maintained that vascular dementia was rarer than previously thought and Alzheimer's disease caused the vast majority of old age mental impairments. More recently however, it is believed that dementia is often a mixture of conditions. In 1976, neurologist Robert Katzmann suggested a link between senile dementia and Alzheimer's disease.[283] Katzmann suggested that much of the senile dementia occurring (by definition) after the age of 65, was pathologically identical with Alzheimer's disease occurring in people under age 65 and therefore should not be treated differently.[284] Katzmann thus suggested that Alzheimer's disease, if taken to occur over age 65, is actually common, not rare, and was the fourth- or 5th-leading cause of death, even though rarely reported on death certificates in 1976. A helpful finding was that although the incidence of Alzheimer's disease increased with age (from 5–10% of 75-year-olds to as many as 40–50% of 90-year-olds), no threshold was found by which age all persons developed it. This is shown by documented supercentenarians (people living to 110 or more) who experienced no substantial cognitive impairment. Some evidence suggests that dementia is most likely to develop between ages 80 and 84 and individuals who pass that point without being affected have a lower chance of developing it. Women account for a larger percentage of dementia cases than men, although this can be attributed to their longer overall lifespan and greater odds of attaining an age where the condition is likely to occur.[285] Much like other diseases associated with aging, dementia was comparatively rare before the 20th century, because few people lived past 80. Conversely, syphilitic dementia was widespread in the developed world until it was largely eradicated by the use of penicillin after World War II. With significant increases in life expectancy thereafter, the number of people over 65 started rapidly climbing. While elderly persons constituted an average of 3–5% of the population prior to 1945, by 2010 many countries reached 10–14% and in Germany and Japan, this figure exceeded 20%. Public awareness of Alzheimer's Disease greatly increased in 1994 when former US president Ronald Reagan announced that he had been diagnosed with the condition. In the 21st century, other types of dementia were differentiated from Alzheimer's disease and vascular dementias (the most common types). This differentiation is on the basis of pathological examination of brain tissues, by symptomatology, and by different patterns of brain metabolic activity in nuclear medical imaging tests such as SPECT and PET scans of the brain. The various forms have differing prognoses and differing epidemiologic risk factors. The main cause for many diseases, including Alzheimer's disease, remains unclear.[286] Terminology Dementia in the elderly was once called senile dementia or senility, and viewed as a normal and somewhat inevitable aspect of aging.[287][288] By 1913–20 the term dementia praecox was introduced to suggest the development of senile-type dementia at a younger age. Eventually the two terms fused, so that until 1952 physicians used the terms dementia praecox (precocious dementia) and schizophrenia interchangeably. Since then, science has determined that dementia and schizophrenia are two different disorders, though they share some similarities.[289] The term precocious dementia for a mental illness suggested that a type of mental illness like schizophrenia (including paranoia and decreased cognitive capacity) could be expected to arrive normally in all persons with greater age (see paraphrenia). After about 1920, the beginning use of dementia for what is now understood as schizophrenia and senile dementia helped limit the word's meaning to "permanent, irreversible mental deterioration". This began the change to the later use of the term. In recent studies, researchers have seen a connection between those diagnosed with schizophrenia and patients who are diagnosed with dementia, finding a positive correlation between the two diseases.[290] The view that dementia must always be the result of a particular disease process led for a time to the proposed diagnosis of "senile dementia of the Alzheimer's type" (SDAT) in persons over the age of 65, with "Alzheimer's disease" diagnosed in persons younger than 65 who had the same pathology. Eventually, however, it was agreed that the age limit was artificial, and that Alzheimer's disease was the appropriate term for persons with that particular brain pathology, regardless of age. After 1952, mental illnesses including schizophrenia were removed from the category of organic brain syndromes, and thus (by definition) removed from possible causes of "dementing illnesses" (dementias). At the same, however, the traditional cause of senile dementia – "hardening of the arteries" – now returned as a set of dementias of vascular cause (small strokes). These were now termed multi-infarct dementias or vascular dementias. |
歴史 このセクションの検証には追加の引用が必要である。このセクションに信頼できる情報源への引用を追加することで、この記事の改善にご協力いただきたい。 ソースのないものは異議申し立てされ、削除される可能性がある。(2015年11月)(このメッセージを削除する方法とタイミングを学ぶ) 以下も参照のこと: 若年性認知症 19世紀末まで、認知症はより広範な臨床概念であった。この頃の認知症は、単に理性を失った人を指しており、精神病、脳を破壊する梅毒のような「器質的」 疾患、「動脈硬化」に起因する老齢に伴う認知症に等しく適用されていた[277]。  19世紀に描かれた認知症と診断された女性の絵 認知症は古代から医学書にも登場している。認知症に関する最も古い言及のひとつは、紀元前7世紀のギリシャの哲学者ピタゴラスによるもので、彼は人間の寿 命を6つの段階に分けている: 0-6歳(幼児期)、7-21歳(青年期)、22-49歳(青年期)、50-62歳(中年期)、63-79歳(老年期)、80-死(老年期)である。最後 の2つは「老年期」であり、精神的にも肉体的にも衰える時期であるとし、最終段階は「非常に幸いなことに、人類の種の中でほとんど到達することのない、死 すべき存在の場面が、非常に長い時間の後に閉じられるときであり、そこでは精神は幼児期の最初の時期の無能さにまで低下する」[278]と述べている。 紀元前550年、アテナイの政治家であり詩人であったソロンは、高齢のために判断力が失われた場合、人間の意志の条件は無効になる可能性があると主張し た。中国の医学書にもこの症状についての言及があり、「痴呆」の字は直訳すると「愚かな老人」となる[279]。 アテナイの哲学者であるアリストテレスとプラトンは、老齢に伴う精神的な衰えについて議論し、これは老齢になるすべての人に影響するものであり、この衰え を止めることはできないと予言していた。プラトンは特に、高齢者は責任のある地位に就くべきではないと語った。なぜなら、「かつて若い頃に彼らを支えてい た心の才覚、判断力、想像力、推理力、記憶力と呼ばれるような特性はあまりない。彼らは、劣化によってそれらが徐々に鈍化していくのを目の当たりにし、そ の機能をほとんど果たすことができない」[280]。 比較のために、ローマの政治家キケロは、精神機能の喪失は高齢者において不可避ではなく、「意志の弱い老人だけに影響する」という、現代の医学の常識には るかに沿った見解を持っていた。彼は、精神的に活動的で新しいことを学ぶことに熱心な人が、いかに認知症を食い止めることができるかを語った。しかし、キ ケロの老化に対する見解は、進歩的ではあったが、アリストテレスの医学書が何世紀にもわたって支配する世界では、ほとんど無視された。ガレンやケルススの ようなローマ帝国時代の医師たちは、アリストテレスの信念を繰り返すだけで、医学的知識への新たな貢献はほとんどなかった。 ビザンチン帝国の医師たちは、認知症について書くこともあった。寿命が70歳を超えた皇帝のうち、少なくとも7人に認知機能低下の兆候が見られたと記録さ れている。コンスタンチノープルでは、認知症や精神異常と診断された人々を収容する特別な病院があったが、法の上にあり、その健康状態を公に認めることの できない皇帝たちには適用されなかった。 それ以外には、1700年近くもの間、西洋の医学書には認知症に関する記述はほとんどない。数少ない文献のひとつは、13世紀の修道士ロジャー・ベーコン で、彼は老いを原罪に対する神の罰とみなした。彼は、認知症は避けられないという既存のアリストテレス派の信念を繰り返したが、記憶と思考の中心は心臓で はなく脳であるという進歩的な主張を行った。 詩人、劇作家、その他の作家たちは、老年期の精神機能の喪失について頻繁に言及している。ウィリアム・シェイクスピアは、『ハムレット』や『リア王』など の戯曲の中で、特にこのことに言及している。 19世紀、医師たちは一般的に高齢者の痴呆は脳動脈硬化の結果であると考えるようになった。しかし、痴呆は脳に栄養を供給している大動脈の閉塞によるもの であるとか、大脳皮質の血管内の小さな脳卒中によるものであるとか、さまざまな意見があった。 1907年、バイエルンの精神科医であったアロイス・アルツハイマーは、51歳のオーギュスト・データーの脳における進行性痴呆の特徴を初めて特定し、記 述した[281]。データーは、夫の不倫を非難し、家事を怠り、筆談や会話に困難を示し、不眠が強くなり、方向感覚を失うなど、常軌を逸した行動をとるよ うになっていた。 [アルツハイマーは、1901年11月25日にフランクフルトの精神病院に入院したデターの治療を開始した[282]。継続的な治療中、デターと彼女の夫 は医療費を捻出するのに苦労し、アルツハイマーはデターの医療記録と死亡時の脳の提供と引き換えに治療を継続することに同意した。 [282] デターは1906年4月8日、敗血症と肺炎に倒れ死亡した。アルツハイマーは、当時としては新しい開発であったビエルショウスキー染色法を用いて脳生検を 行い、老人斑、神経原線維変化、アテローム性動脈硬化の変化を観察した[281]。 [281]当時、医学者の間では、老人斑は一般的に高齢の患者に見られるというコンセンサスが得られており、神経原線維のもつれの発生は、当時としては全 く新しい観察であった。 [282]アルツハイマーは、1906年4月11日にテュービンゲンで開催されたドイツ南西部の第37回精神医学会議で彼の発見を発表したが、その情報は 彼の同僚からはあまり受け入れられなかった[282]。 1910年までに、アロイス・アルツハイマーの師であるエミール・クレーペリンは、アルツハイマーの発見の重要性を認めようとして「アルツハイマー病」と いう造語を使った本を出版した[281][282]。 1960年代までに、神経変性疾患と加齢に伴う認知機能低下との関連性はより確立されていた。1970年代には、医学界は、血管性痴呆は以前考えられてい たよりもまれであり、アルツハイマー病が老年期の精神障害の大部分を引き起こしていると主張していた。しかし、最近では、認知症は多くの場合、複数の病態 が混在していると考えられている。 1976年、神経科医のRobert Katzmannは、老人性痴呆とアルツハイマー病の関連を示唆した[283]。Katzmannは、(定義上)65歳以降に発生する老人性痴呆の多く は、65歳未満で発生するアルツハイマー病と病理学的に同一であり、異なる扱いをすべきではないと示唆した。 [284] このようにKatzmannは、アルツハイマー病は65歳以降に発症すると考えれば、実際にはまれではなく一般的であり、1976年の死亡診断書ではほと んど報告されていなかったが、4番目か5番目の主要な死因であったことを示唆した。 アルツハイマー病の発症率は年齢とともに増加するが(75歳の5-10%から90歳の40-50%まで)、どの年齢までにすべての人が発症するかという閾 値は見つかっていない。このことは、実質的な認知機能障害を経験しなかったスーパーセンテナリアン(110歳以上生きた人)が記録されていることからもわ かる。認知症は80歳から84歳の間に発症する可能性が最も高く、発症せずにその時期を過ぎた人は発症する可能性が低いという証拠もある。女性の方が男性 よりも認知症患者の割合が多いが、これは女性の方が全体的な寿命が長く、認知症が発症しやすい年齢に達する確率が高いためと考えられる[285]。 老化に関連する他の疾患と同様に、認知症は20世紀以前には比較的まれであった。逆に、梅毒性認知症は、第二次世界大戦後にペニシリンの使用によってほと んど根絶されるまで、先進国で広く蔓延していた。その後、平均寿命が大幅に延び、65歳以上の人口は急速に増加し始めた。1945年以前は高齢者が人口の 平均3〜5%を占めていたが、2010年には多くの国で10〜14%に達し、ドイツや日本では20%を超えている。1994年、ロナルド・レーガン元米大 統領がアルツハイマー病と診断されたことを発表したことで、アルツハイマー病に対する社会的認知度は大きく高まった。 21世紀には、他のタイプの認知症がアルツハイマー病や血管性認知症(最も一般的なタイプ)と区別されるようになった。この鑑別は、脳組織の病理学的検 査、症状、脳のSPECTやPETスキャンなどの核医学画像検査における脳代謝活性のパターンの違いによって行われる。様々な病型は予後が異なり、疫学的 危険因子も異なる。アルツハイマー病を含む多くの疾患の主な原因は不明である[286]。 用語 高齢者の認知症は、かつては老人性認知症または老衰と呼ばれ、老化の正常かつある程度不可避な側面とみなされていた[287][288]。 1913年から20年にかけて、若年での老人性痴呆の発症を示唆するために、認知症(dementia praecox)という用語が導入された。やがて2つの用語は融合し、1952年まで医師は認知症(早発性認知症)と統合失調症という用語を使い分けてい た。それ以来、認知症と精神分裂病は、いくつかの類似点はあるものの、2つの異なる疾患であると科学的に判断されるようになった[289]。精神疾患に対 する早発性認知症という用語は、精神分裂病のようなタイプの精神疾患(パラノイアや認知能力の低下を含む)は、年齢が高くなるにつれてすべての人に正常に 到来すると予想されることを示唆していた(パラフレニアを参照)。1920年頃以降、現在統合失調症や老人性痴呆症として理解されているものに痴呆症が使 われ始めたことで、この言葉の意味が「永続的で不可逆的な精神劣化」に限定されるようになった。これが、後の用語の使われ方への変化の始まりである。最近 の研究では、統合失調症と診断された患者と認知症と診断された患者の間に関連性が見られ、2つの疾患の間に正の相関関係があることが判明している [290]。 認知症は常に特定の疾患プロセスの結果でなければならないという見解から、一時期、65歳以上の人を「アルツハイマー型老人性認知症」(SDAT)と診断 し、同じ病態を持つ65歳未満の人を「アルツハイマー病」と診断することが提案された。しかし、最終的には、この年齢制限は人為的なものであり、年齢に関 係なく、その特殊な脳の病態を持つ人にはアルツハイマー病が適切であるということで合意された。 1952年以降、統合失調症を含む精神疾患は脳の器質的症候群のカテゴリーから除外され、したがって(定義上)「痴呆性疾患」(認知症)の可能性のある原 因から除外された。しかし、同時に、従来の老人性痴呆の原因であった「動脈硬化」は、血管性痴呆(小さな脳卒中)として復活した。これらは多発性脳梗塞性 痴呆または血管性痴呆と呼ばれるようになった。 |
Society and culture Woman with dementia being cared for at home in Ethiopia The societal cost of dementia is high, especially for caregivers.[291] According to a UK-based study, almost two out of three carers of people with dementia feel lonely. Most of the carers in the study were family members or friends.[292][293] As of 2015, the annual cost per Alzheimer's patient in the United States was around $19,144.36. The total costs for the nation is estimated to be about $167.74 billion. By 2030, it is predicted the annual socioeconomic cost will total to about $507 billion, and by 2050 that number is expected to reach $1.89 trillion. This steady increase will be seen not just within the United States but globally. Global estimates for the costs of dementia were $957.56 billion in 2015, but by 2050 the estimated global cost is $9.12 trillion.[294] Many countries consider the care of people living with dementia a national priority and invest in resources and education to better inform health and social service workers, unpaid caregivers, relatives and members of the wider community. Several countries have authored national plans or strategies.[295][296] These plans recognize that people can live reasonably with dementia for years, as long as the right support and timely access to a diagnosis are available. Former British Prime Minister David Cameron described dementia as a "national crisis", affecting 800,000 people in the United Kingdom.[297] In fact, dementia has become the leading cause of death for women in England.[298] There, as with all mental disorders, people with dementia could potentially be a danger to themselves or others, they can be detained under the Mental Health Act 1983 for assessment, care and treatment. This is a last resort, and is usually avoided by people with family or friends who can ensure care. Some hospitals in Britain work to provide enriched and friendlier care. To make the hospital wards calmer and less overwhelming to residents, staff replaced the usual nurses' station with a collection of smaller desks, similar to a reception area. The incorporation of bright lighting helps increase positive mood and allow residents to see more easily.[299] Driving with dementia can lead to injury or death. Doctors should advise appropriate testing on when to quit driving.[300] The United Kingdom DVLA (Driver & Vehicle Licensing Agency) states that people with dementia who specifically have poor short-term memory, disorientation, or lack of insight or judgment are not allowed to drive, and in these instances the DVLA must be informed so that the driving license can be revoked. They acknowledge that in low-severity cases and those with an early diagnosis, drivers may be permitted to continue driving. Many support networks are available to people with dementia and their families and caregivers. Charitable organizations aim to raise awareness and campaign for the rights of people living with dementia. Support and guidance are available on assessing testamentary capacity in people with dementia.[301] In 2015, Atlantic Philanthropies announced a $177 million gift aimed at understanding and reducing dementia. The recipient was Global Brain Health Institute, a program co-led by the University of California, San Francisco and Trinity College Dublin. This donation is the largest non-capital grant Atlantic has ever made, and the biggest philanthropic donation in Irish history.[302] In October 2020, the Caretaker's last music release, Everywhere at the End of Time, was popularized by TikTok users for its depiction of the stages of dementia.[303] Caregivers were in favor of this phenomenon; Leyland Kirby, the creator of the record, echoed this sentiment, explaining it could cause empathy among a younger public.[304] On November 2, 2020, Scottish billionaire Sir Tom Hunter donated £1 million to dementia charities, after watching a former music teacher with dementia, Paul Harvey, playing one of his own compositions on the piano in a viral video. The donation was announced to be split between the Alzheimer's Society and Music for Dementia.[305] Awareness Celebrities have used their platforms to raise awareness for the different forms of dementia and the need for further support, including former First Lady of California Maria Shriver, Maria Shriver | My Brain™ | Alzheimer’s Association Academy Award Winning actor Samuel L. Jackson, Editor-in-Chief of ELLE Magazine Nina Garcia, professional skateboarder Tony Hawk, and others.[306] Additional Alzheimer's awareness has been raised through the diagnoses of high-profile persons themselves, including Actor Bruce Willis[307] Actor Robin Williams[308] Activist Rosa Parks[309] 40th President of the United States, Ronald Reagan[310] Former Mrs. Colorado Springs Joanna Fix Mrs. Colorado Springs uses title, young-onset Alzheimer's diagnosis to spread awareness about dementia TV Host Wendy Williams Wendy Williams diagnosed with same form of dementia as Bruce Willis Musician Tony Bennett[311] Musician Maureen McGovern[312] Dancer and pin-up model Rita Hayworth Rita Hayworth's misdiagnosed struggle |
社会と文化 エチオピアで自宅で介護される認知症の女性 認知症の社会的コストは、特に介護者にとって高い[291]。 イギリスの調査によると、認知症患者の介護者の3人に2人は孤独を感じている。この研究の介護者のほとんどは家族か友人であった[292][293]。 2015年の時点で、米国におけるアルツハイマー病患者一人当たりの年間費用は約19,144.36ドルであった。国民の総費用は約1,677億 4,000万ドルと推定されている。2030年までに、社会経済的な年間コストは5070億ドルに達し、2050年には1兆8900億ドルに達すると予測 されている。この着実な増加は、米国内だけでなく、世界的に見られることになる。認知症の世界的な推定コストは、2015年には9,575億6,000万 ドルであったが、2050年には9兆1,200億ドルになると推定されている[294]。 多くの国民が認知症患者のケアを国家的な優先事項と考えており、医療・福祉サービス従事者、無報酬の介護者、親族、より広いコミュニティのメンバーにより 良い情報を提供するための資源や教育に投資している。これらの計画は、適切な支援と診断へのタイムリーなアクセスさえあれば、認知症であっても何年も合理 的に生きることができることを認めている[295][296]。キャメロン前英国首相は、認知症を「国民的危機」と表現し、英国では80万人が影響を受け ている[297]。事実、認知症は英国における女性の死因の第1位となっている[298]。 そこでは、すべての精神障害と同様に、認知症の人は潜在的に自分自身や他者に対して危険である可能性があり、評価、ケア、治療のために1983年の精神衛 生法の下で拘禁されることがある。これは最後の手段であり、介護を保証できる家族や友人がいる人は通常これを避ける。 イギリスでは、より豊かで親しみやすいケアを提供するために努力している病院もある。病棟を落ち着かせ、住民に圧迫感を与えないようにするため、スタッフ は通常のナースステーションを、受付のような小さな机の集まりに変えた。明るい照明を取り入れることで、前向きな気分になり、入居者の目が届きやすくなる [299]。 認知症での運転は、怪我や死につながる可能性がある。英国のDVLA(Driver & Vehicle Licensing Agency)は、特に短期記憶力の低下、見当識障害、洞察力や判断力の欠如が見られる認知症の人は運転してはならないとしており、このような場合には運 転免許を取り消すことができるようにDVLAに通知しなければならないとしている。DVLAは、重症度の低いケースや早期に診断されたケースでは、運転が 許可される場合があることを認めている。 認知症患者とその家族、介護者には多くの支援ネットワークがある。慈善団体は、認知症患者の権利のための意識向上とキャンペーンを目的としている。認知症 患者の遺言能力の評価に関する支援やガイダンスも提供されている[301]。 2015年、アトランティック・フィランソロピーは、認知症の理解と軽減を目的とした1億7700万ドルの寄付を発表した。寄付先は、カリフォルニア大学 サンフランシスコ校とトリニティ・カレッジ・ダブリン校が共同で主導するプログラムであるGlobal Brain Health Instituteである。この寄付は、アトランティック社がこれまでに行った資本以外の助成金としては最大であり、アイルランド史上最大の慈善寄付と なった[302]。 2020年10月、ケアテイカーの最後の音楽リリースである『Everywhere at the End of Time』は、認知症の段階を描写したことでTikTokユーザーによって広まった[303]。介護者たちはこの現象に賛成しており、レコードの制作者で あるレイランド・カービーもこの感情に共鳴し、若い大衆の共感を引き起こす可能性があると説明した[304]。 2020年11月2日、スコットランドの億万長者であるトム・ハンター卿は、認知症の元音楽教師ポール・ハーヴェイが自作曲をピアノで演奏する様子をバイ ラルビデオで見た後、認知症の慈善団体に100万ポンドを寄付した。寄付金はアルツハイマー病協会とミュージック・フォー・ディメ ンチアで折半されると発表された[305]。 啓発 有名人たちは、認知症のさまざまな形態とさらなる支援の必要性に対する認識を高めるために自らのプラットフォームを利用してきた。カリフォルニア州の元大 統領夫人であるマリア・シュライヴァー(Maria Shriver|My Brain™|アルツハイマー病協会)、アカデミー賞受賞俳優のサミュエル・L・ジャクソン(Samuel L. Jackson)、『ELLE』誌の編集長ニーナ・ガルシア(Nina Garcia)、プロスケートボーダーのトニー・ホーク(Tony Hawk)などがその例である[306]。 さらに、以下のような著名人自身の診断を通じて、アルツハイマーに対する認識が高まっている。 俳優のブルース・ウィリス[307]。 俳優のロビン・ウィリアムズ[308]。 活動家ローザ・パークス[309]。 第40代アメリカ合衆国大統領ロナルド・レーガン[310]。 元コロラドスプリングス夫人ジョアンナ・フィックス・コロラドスプリングス夫人は、認知症についての認識を広めるために、肩書きと若年発症アルツハイマー 病の診断を利用している。 テレビ司会者のウェンディ・ウィリアムズ ウェンディ・ウィリアムズはブルース・ウィリスと同じ認知症と診断された。 ミュージシャンのトニー・ベネット[311] ミュージシャンのモーリーン・マクガバン[312]。 ダンサーでピンナップ・モデルのリタ・ヘイワース リタ・ヘイワースの誤診された闘病生活 |
| https://en.wikipedia.org/wiki/Dementia |
|
リンク
文献
その他の情報
Copyleft, CC, Mitzub'ixi Quq Chi'j, 1996-2099

人工知能に取り組む前に、なぜ人間の愚かさを何とかしないのか?
++
Copyleft,
CC, Mitzub'ixi Quq Chi'j, 1996-2099